Hvilke af egenskabsatomerne er skal passende reference til venlig binding, der finder sted mellem dem?
Her er hvorfor:
* Elektronegativitet er et atoms evne til at tiltrække elektroner mod sig selv inden for en kemisk binding. Forskellen i elektronegativitet mellem to atomer er nøglefaktoren til bestemmelse af bindingstypen:
* ionisk binding: En stor forskel i elektronegativitet (typisk større end 1,7) fører til, at det ene atom effektivt tager et elektron fra det andet, hvilket resulterer i dannelsen af ioner og en elektrostatisk tiltrækning mellem dem.
* kovalent binding: En lille forskel i elektronegativitet (typisk mindre end 1,7) fører til en deling af elektroner mellem atomerne.
* ikke -polær kovalent binding: Lige deling af elektroner på grund af meget ens elektronegativitetsværdier.
* polær kovalent binding: Ulig deling af elektroner på grund af en moderat forskel i elektronegativitet.
Andre egenskaber ved atomer, der spiller en rolle i binding, men ikke er de primære determinanter:
* ioniseringsenergi: Den energi, der kræves for at fjerne et elektron fra et atom. Dette er mere relevant for ionisk binding.
* Elektronaffinitet: Ændringen i energi, når et elektron tilsættes til et neutralt atom. Dette er også mere relevant for ionisk binding.
* atomstørrelse: Større atomer har en tendens til at have lavere elektronegativitet, der påvirker bindingslængde og styrke.
Kortfattet: Mens andre egenskaber ved atomer spiller en rolle, er elektronegativitet den mest afgørende faktor i bestemmelsen af arten af bindingen dannet mellem atomer.
Sidste artikelHvor mange valenselektroner skal aluminium miste være lykkelig?
Næste artikelHvad er melodbar mel?
 Varme artikler
Varme artikler
-
 Hvordan bittesmå enzymer troner øverst i verdensomspændende kulstofgenbrugHvide rådsvampe, Duke Forest, North Carolina Kredit:NA Genanvendelsen af det meste af kulstoffet i naturen afhænger af nedbrydning af to polymerer i træemateriale, især cellulose og lignin. I et
Hvordan bittesmå enzymer troner øverst i verdensomspændende kulstofgenbrugHvide rådsvampe, Duke Forest, North Carolina Kredit:NA Genanvendelsen af det meste af kulstoffet i naturen afhænger af nedbrydning af to polymerer i træemateriale, især cellulose og lignin. I et -
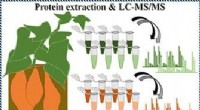 Udgravning af sød kartoffel proteomKredit:American Chemical Society Den søde, stivelsesholdige orange søde kartofler er velsmagende og nærende ingredienser til fritter, gryderetter og tærter. Selvom mennesker har dyrket søde kartof
Udgravning af sød kartoffel proteomKredit:American Chemical Society Den søde, stivelsesholdige orange søde kartofler er velsmagende og nærende ingredienser til fritter, gryderetter og tærter. Selvom mennesker har dyrket søde kartof -
 Fleksibelt termoelektrisk generatormodul:en sølvkugle til at løse problemer med spildenergiFigur 1. Foto og skematisk design af FlexTEG-modulet, foto af Bismuth-telluride (Bi-Te) halvlederchips, og spænding og effekt som funktion af strømmen for FlexTEG-modulet ved forskellige temperaturgra
Fleksibelt termoelektrisk generatormodul:en sølvkugle til at løse problemer med spildenergiFigur 1. Foto og skematisk design af FlexTEG-modulet, foto af Bismuth-telluride (Bi-Te) halvlederchips, og spænding og effekt som funktion af strømmen for FlexTEG-modulet ved forskellige temperaturgra -
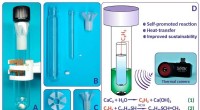 Kemikere opfinder et effektivt termisk kamera for at reducere omkostningerne til kemisk forskningReaktionsopsætningen ved hjælp af den udviklede rør-i-rør-reaktor:(A)—reaktoren klar til brug; (B)—den adskilte reaktor; (C)-nylonforing; (D)—termisk kamera og skemaet for rør-i-rør-reaktor og to trin
Kemikere opfinder et effektivt termisk kamera for at reducere omkostningerne til kemisk forskningReaktionsopsætningen ved hjælp af den udviklede rør-i-rør-reaktor:(A)—reaktoren klar til brug; (B)—den adskilte reaktor; (C)-nylonforing; (D)—termisk kamera og skemaet for rør-i-rør-reaktor og to trin
- Hvordan blev en gammel plante fra Latinamerika Asiens næstvigtigste kontantafgrøde?
- Hvad er navnet på undersøgelsens bakterier og vira?
- Hvor er den metalliske karakter på periodisk tabel?
- Hvordan tilpasser dyrene sig til den tempererede regnskov?
- Hvad i et køleskab forhindrer, at bakterier og svampe kommer på maden?
- Landmænd bruger teknologi til at presse hver dråbe fra Colorado River


