Hvorfor nitrogenes valency ikke 5 i N2O5?
* Valency vs. Valence Electrons: Valenselektroner er elektronerne i den yderste skal af et atom, der deltager i binding. Valency henviser imidlertid til antallet af bindinger, som et atom kan danne.
* nitrogens bindingsadfærd: Nitrogen har en tendens til at danne tre Kovalente bindinger for at opnå en stabil oktet (8 elektroner i dens ydre skal). I N₂O₅ danner nitrogen tre Bindinger:To med iltatomer i den centrale NO₂ -gruppe og en med et iltatom i en terminal NO₂ -gruppe.
Her er nedbrydningen af strukturen:
* centralt nitrogen: Det centrale nitrogenatom danner tre bindinger (en dobbelt og to enkelt) og har en formel ladning på +1.
* terminal nitrogen: De terminale nitrogenatomer danner tre bindinger (en dobbelt og to enkelt) og har en formel ladning på +1.
* Oxygenatomer: Oxygenatomerne danner to bindinger hver og har en formel afgift på -1.
I N₂O₅ er nitrogens valens derfor 4, ikke 5, fordi det danner fire obligationer.
Fortæl mig, hvis du har flere spørgsmål om kemisk binding!
 Varme artikler
Varme artikler
-
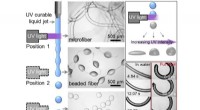 Høst af mikropartikler fra en flydende stråleAfhængigt af placeringen af UV -bestrålingen af væskestrålen, fibre, beaded fibre eller mikropartikler dannes. Kredit:University of Twente Mikrosfærer, mikrolinser og mikrofibre kan nu fremsti
Høst af mikropartikler fra en flydende stråleAfhængigt af placeringen af UV -bestrålingen af væskestrålen, fibre, beaded fibre eller mikropartikler dannes. Kredit:University of Twente Mikrosfærer, mikrolinser og mikrofibre kan nu fremsti -
 Alsidig, hurtig og pålidelig SARS-CoV-2 antistofanalyseBaseret på den dokumenterede MCR-mikroarray-analyseplatform fra det München-baserede GWK Praezisionstechnik GmbH har forskere ved Münchens Tekniske Universitet udviklet en ny mikroarray-baseret hurtig
Alsidig, hurtig og pålidelig SARS-CoV-2 antistofanalyseBaseret på den dokumenterede MCR-mikroarray-analyseplatform fra det München-baserede GWK Praezisionstechnik GmbH har forskere ved Münchens Tekniske Universitet udviklet en ny mikroarray-baseret hurtig -
 Små bobler på elektroderne er nøglen til at fremskynde kemiske processerKredit:Curtin University Ny Curtin University-ledet forskning har vist dannelsen af bobler på elektroder, normalt anset for at være en hindring, kan være gavnligt, med bevidst tilføjede bobler,
Små bobler på elektroderne er nøglen til at fremskynde kemiske processerKredit:Curtin University Ny Curtin University-ledet forskning har vist dannelsen af bobler på elektroder, normalt anset for at være en hindring, kan være gavnligt, med bevidst tilføjede bobler, -
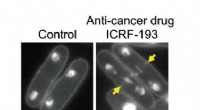 Anticancer-mekanisme afsløret i gæreksperimenterMed DNA topoisomerase II (topo II) intakt, DNA i fissionsgærceller replikeres normalt og deles jævnt mellem to datterceller (venstre). Når det er under virkningen af anti-cancer lægemidlet ICRF-193,
Anticancer-mekanisme afsløret i gæreksperimenterMed DNA topoisomerase II (topo II) intakt, DNA i fissionsgærceller replikeres normalt og deles jævnt mellem to datterceller (venstre). Når det er under virkningen af anti-cancer lægemidlet ICRF-193,
- Kønsroller i oldtiden
- COVID-19 afslører yderligere uligheder i det globale finansielle system
- Motor med en diameter på fem millimeter drives direkte med lys
- Nye værktøjer afslører, hvordan gener fungerer, og celler organiserer sig
- NASA opdager resterne af Tropical Cyclone 02Ws i det Sydkinesiske Hav
- hvor er oprindelsen af et menneske?


