Anticancer-mekanisme afsløret i gæreksperimenter
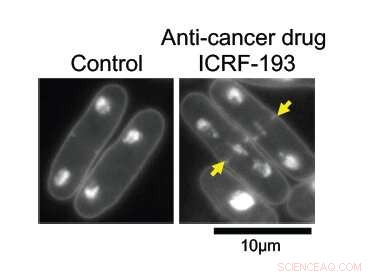
Med DNA topoisomerase II (topo II) intakt, DNA i fissionsgærceller replikeres normalt og deles jævnt mellem to datterceller (venstre). Når det er under virkningen af anti-cancer lægemidlet ICRF-193, DNA'et bliver sammenfiltret i midten af modercellen, forhindrer dens rene opdeling. Kredit:Okinawa Institute of Science and Technology Graduate University
Meget ligesom snørebånd eller hængende halskæder, DNA-strenge kan vikle sig sammen i uregerlige knuder. Specialiserede enzymer holder DNA organiseret, når celler deler sig, så cellerne deler sig jævnt og ikke sætter sig fast. Men i tumorceller, denne fejlsikre tillader kræft at sprede sig. Nu, forskere ved Okinawa Institute of Science and Technology Graduate University (OIST) har lært, hvordan denne mekanisme virker i fissionsgær, og hvordan den kan undermineres ved kræft hos mennesker.
Studiet, offentliggjort online den 11. januar, 2019 af Journal of Biological Chemistry , fokuserer på et veletableret mål for kræftbehandling:DNA topoisomerase II, eller topo II for kort. Topo II regulerer topologien af DNA, styring af strengenes skiftende struktur over tid. Kræftceller viser øget topo II-aktivitet, hvilket igen ansporer tumorvækst. Topo II kræftlægemidler undertrykker enzymets funktion, forhindre tumorceller i at replikere og forhindre spredning af kræft.
Men eksisterende topo II-lægemidler har vist begrænset succes - videnskabsmænd har brug for at vide mere om den grundlæggende mekanisme, før de kan sløve den effektivt.
"Mange forskere arbejder på topo II, men de bruger hovedsageligt menneskelige eller højere eukaryote celler, " sagde Dr. Norihiko Nakazawa, første forfatter til undersøgelsen og en stabsforsker i OIST G0 Cell Unit, ledet af prof. Mitsuhiro Yanagida. Enheden valgte at studere topo II i fissionsgær, fordi dens celledelingsmekanismer stort set er bevaret hos mennesker, han sagde, udover at være hurtig og nem at manipulere.
DNA topoisomerase II (topo II), en mesterregulator af DNA-metabolisme til celleproliferation, er et kritisk mål for kræftbehandling. Kredit:Okinawa Institute of Science and Technology Graduate University
"Vi kan hurtigt fange topo II-reaktionen i gær, derefter gå videre til at studere det i menneskelige celler, " sagde Nakazawa. "Vores arbejde viser, at gær er en god model til at screene topo II-lægemidler og ville være en hurtig metode at bruge i kliniske applikationer."
Forøgelse af effektiviteten af lægemidler mod kræft
Forskerne havde til formål at lære, hvordan topo II fungerer på et molekylært niveau. Ved større forstørrelser, dens virkninger er indlysende; celler med det intakte enzym deler sig normalt, med halvdelen af deres replikerede genetiske materiale på hver side af spalten. Uden topo II, DNA'et forbliver sammenfiltret i midten af modercellen, forhindrer dens korrekte deling i to datterceller.
Tidligere forskning tyder på, at topo II er afhængig af phosphorylering - tilføjelsen af en phosphatgruppe på præcise steder i dens struktur. I fissionsgær og menneskeceller, enzymet kasein kinase II, også kendt som CKII, trin ind for at fosforylere specifikke områder af topo II. I dette arbejde, Nakazawa identificerede disse regioner og fandt ud af, at nogle forblev phosphorylerede gennem hele cellecyklussen. Denne konstante kemiske udveksling øgede aktiviteten i en region af topo II kendt som "ATPase-domænet." Selvom forskerne observerede forbedringen, i første omgang, de kunne ikke fortælle, hvordan det faktisk ændrede topo II-funktionen.
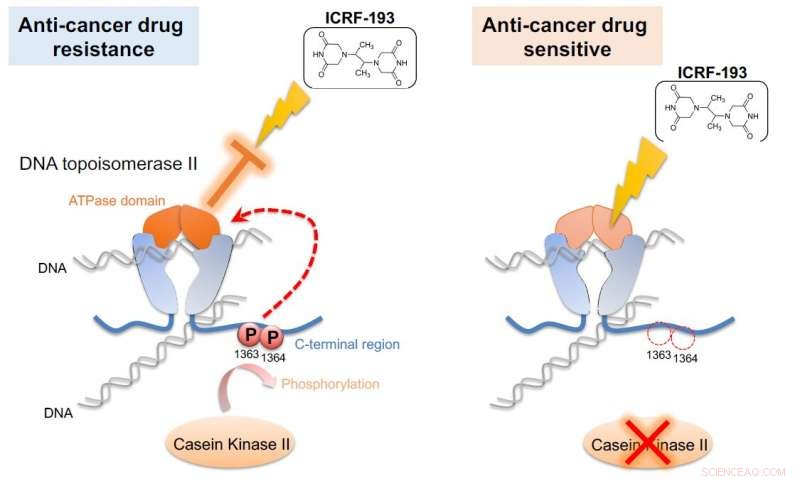
Kaseinkinase II (CKII) phosphorylerer DNA-topoisomerase II (topo II), dermed aktiverer ATPase-domænet af enzymet (venstre). Denne aktivering annullerer virkningerne af anti-cancer-lægemidlet ICRF-193. Hvis CKII-aktivitet er dæmpet (til højre), effektiviteten af ICRF-193 er reddet. G0 Cell Unit demonstrerede denne mekanisme i fissionsgær, en simpel model, der kunne bruges til screening af lægemidler mod kræft. Kredit:Okinawa Institute of Science and Technology Graduate University
Forskerne løste gåden ved at kaste et topo II-lægemiddel i blandingen. Lægemidlet ICRF-193 virker ved at hæmme ATPase-aktiviteten af topo II, som effektivt fanger DNA i en stram konfiguration, så det ikke kan udføre enzymatiske reaktioner. Men i nærværelse af CKII, som øger ATPase aktivitet, lægemidlet gøres ineffektivt.
"Denne [ATPase-domæne]-forbedring brød anticancermedicinens effekt, " sagde Nakazawa. "Hvis vi blokerer for fosforyleringen, denne aktivering sker ikke, og stoffet forbliver effektivt."
Potentielt grundlag for nye terapier
Beviser tyder på, at topo II og CKII interagerer i humane celler, ligesom de gør i fissionsgær. Kræftceller udtrykker højere niveauer af både topo II og CKII end normalt væv, og begge enzymer er blevet forbundet med unormal celleproliferation. Nu hvor videnskabsmænd forstår den underliggende mekanisme i gær, den viden kan de anvende i fremtidige undersøgelser af humane kræftceller. En skønne dag, forskningen kan føre til nye kræftbehandlinger.
"Hvis vi hæmmer CKII og topo II, det kunne være en meget effektiv måde at hæmme kræftcelledeling, " sagde Nakazawa. "Denne additive effekt kunne være meget kraftfuld i kræftbehandling."
Sidste artikelForskere sporer nye biokatalysatorer
Næste artikelUsædvanligt sukker fra cyanobakterier virker som naturligt herbicid
 Varme artikler
Varme artikler
-
 Grønnere, hurtigere og billigere måde at lave mønstrede metaller til solceller og elektronikAlle tre forskere fra venstre mod højre:Dr. Ross Hatton, Dr Silva Varagnolo og Dr. Jaemin Lee. Kredit:University of Warwick En innovativ måde at mønstre metaller er blevet opdaget af forskere ved
Grønnere, hurtigere og billigere måde at lave mønstrede metaller til solceller og elektronikAlle tre forskere fra venstre mod højre:Dr. Ross Hatton, Dr Silva Varagnolo og Dr. Jaemin Lee. Kredit:University of Warwick En innovativ måde at mønstre metaller er blevet opdaget af forskere ved -
 En metode til at genvinde skjulte serienumre fra polymerprodukterGendannelse af slettede serienumre i en polymer. Kredit:American Chemical Society Polymerer er meget udbredt i industrien og anvendes i stigende grad som erstatninger for metaller ved fremstilling
En metode til at genvinde skjulte serienumre fra polymerprodukterGendannelse af slettede serienumre i en polymer. Kredit:American Chemical Society Polymerer er meget udbredt i industrien og anvendes i stigende grad som erstatninger for metaller ved fremstilling -
 Det periodiske system påvirker stadig forskning i dagI år markeres 150 -året for det periodiske system, og de principper, der drev Dmitri Mendeleev til at konstruere sit bord, påvirker stadig dagens forskningsfremskridt. Kredit:MSU I år markeres 150
Det periodiske system påvirker stadig forskning i dagI år markeres 150 -året for det periodiske system, og de principper, der drev Dmitri Mendeleev til at konstruere sit bord, påvirker stadig dagens forskningsfremskridt. Kredit:MSU I år markeres 150 -
 Opdagelsen af knock-on kemi åbner nye grænser inden for reaktionsdynamikEn kunstners fortolkning af den energibarriere, som et reagensfluoratom skal krydse, når det kolliderer med et fluormethylmolekyle på vej til at danne et produkt som følge af en kemisk reaktion. Forsk
Opdagelsen af knock-on kemi åbner nye grænser inden for reaktionsdynamikEn kunstners fortolkning af den energibarriere, som et reagensfluoratom skal krydse, når det kolliderer med et fluormethylmolekyle på vej til at danne et produkt som følge af en kemisk reaktion. Forsk
- Forskning finder, at flere næringsstoffer er nødvendige for, at planteplankton kan trives
- Hacking af den menneskelige hjerne med social marketing
- Nye muligheder for hav- og klimamodellering
- Styrer cellulær funktion på nanooverflader
- Politikere og regeringer undertrykker videnskaben, hævder BMJ
- Video:Optagelser viser, hvordan droner kan øge bevaring af skildpadder


