Processen, hvorved vandmolekyler omgiver ioner under opløsningen kaldes?
Her er hvorfor:
* vand er et polært molekyle: Oxygenenden af et vandmolekyle har en delvis negativ ladning, mens brintens ender har delvis positive ladninger.
* ioner er ladede partikler: Når ioniske forbindelser opløses, adskiller deres ioner sig.
* attraktion: De modsatte afgifter tiltrækker. De delvist negative iltender af vandmolekyler tiltrækkes af de positive ioner, mens de delvist positive brintender tiltrækkes af de negative ioner.
* omgivende: Denne attraktion får vandmolekyler til at klynge sig omkring ionerne, effektivt omgiver dem og isolere dem fra hinanden.
Denne proces er afgørende for at opløse ioniske forbindelser i vand.
Sidste artikelForekommer alle reaktioner af fotosyntesen i klorofylen?
Næste artikelHvad er varmen af formationssiliciumgas?
 Varme artikler
Varme artikler
-
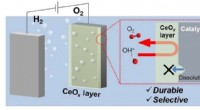 Afskærmning af iltproduktion for at holde brint på vejDen porøse belægning øger holdbarheden af oxygendannende katalysatorer, som industrien ivrigt efterspørger. Kredit:KAUST En porøs ceriumbaseret belægning øger holdbarheden af oxygendannende ka
Afskærmning af iltproduktion for at holde brint på vejDen porøse belægning øger holdbarheden af oxygendannende katalysatorer, som industrien ivrigt efterspørger. Kredit:KAUST En porøs ceriumbaseret belægning øger holdbarheden af oxygendannende ka -
 Forskere konstruerer hårdere mikrober for at forbedre bioproduktion af brændstoffer, kemikalierForskere arbejder på at identificere og producere robuste enzymer, der kan erstatte andre enzymer, der nedbrydes i gæringen af biobaserede brændstoffer og kemikalier. Kredit:Laura Jarboe. Travl,
Forskere konstruerer hårdere mikrober for at forbedre bioproduktion af brændstoffer, kemikalierForskere arbejder på at identificere og producere robuste enzymer, der kan erstatte andre enzymer, der nedbrydes i gæringen af biobaserede brændstoffer og kemikalier. Kredit:Laura Jarboe. Travl, -
 Mikrofluidiske enheder afklarer, hvordan dispergeringsmidler modificerer asfalten for at holde rør …Ris postdoc-forsker Peng He, venstre, og kandidatstuderende Yu-Jiun Lin kører en prøve af råolie gennem en mikrofluidisk enhed, der giver dem mulighed for at se opbygningen af asfaltener i realtid.
Mikrofluidiske enheder afklarer, hvordan dispergeringsmidler modificerer asfalten for at holde rør …Ris postdoc-forsker Peng He, venstre, og kandidatstuderende Yu-Jiun Lin kører en prøve af råolie gennem en mikrofluidisk enhed, der giver dem mulighed for at se opbygningen af asfaltener i realtid. -
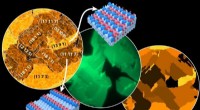 Anisotropi af overfladeoxiddannelse påvirker den forbigående aktivitet af en overfladereaktionFra venstre mod højre:Yndlingssteder for ilt:kort over Rh-oxidation, målt ved Scanning Photoelectron Microscopy (SPEM); in situ fotoemissionselektronmikroskopi (PEEM) af katalytisk hydrogenoxidation p
Anisotropi af overfladeoxiddannelse påvirker den forbigående aktivitet af en overfladereaktionFra venstre mod højre:Yndlingssteder for ilt:kort over Rh-oxidation, målt ved Scanning Photoelectron Microscopy (SPEM); in situ fotoemissionselektronmikroskopi (PEEM) af katalytisk hydrogenoxidation p
- Maskinlæring opdager nye sekvenser for at booste medicinlevering
- Det mindste farvebillede, der nogensinde er trykt
- Forskere fremstiller nyt ternært keramisk fosfor til varme hvide lysdioder
- Canadisk militær i alarmberedskab, da skovbrande raser
- Forskere afslører den interdekadale variabilitet af det afro-asiatiske sommermonsunsystem
- Proteiner, der binder til DNA og tænder operoner ved at gøre det lettere for RNA-polymerase en pro…


