Hvad sker der, hvis et produkt føjes til systemet i ligevægt?
le Chateliers princip
Dette fænomen forklares af Le Chateliers princip, der siger:
* Hvis der anvendes en ændring af betingelsen på et system i ligevægt, skifter systemet i en retning, der lindrer stresset.
Tilføjelse af et produkt
At tilføje et produkt til et system i ligevægt er en stress på systemet. For at lindre denne stress skifter ligevægten til venstre , der favoriserer omvendt reaktion .
Hvorfor skifter det til venstre
* Øget produktkoncentration: Ved at tilføje mere produkt øger du dens koncentration. Systemet forsøger at reducere dette overskydende produkt ved at konvertere det tilbage til reaktanter.
* genoprettelse af ligevægt: Reaktionen skifter, indtil en ny ligevægt er nået, hvor produktkoncentrationen er lidt lavere, og reaktantkoncentrationen er lidt højere.
Eksempel:Haber -processen
Overvej Haber -processen til produktion af ammoniak:
N₂ (g) + 3H₂ (g) ⇌ 2nh₃ (g)
* Hvis ammoniak (NH₃) tilsættes til systemet ved ligevægt, skifter reaktionen til venstre, hvilket favoriserer dannelsen af nitrogen (N₂) og brint (H₂).
Vigtig note: Omfanget af skiftet afhænger af størrelsen af ændringen i koncentration og ligevægtskonstanten (K) af reaktionen.
Sidste artikelHvilket atom af kulstof har 6 protoner?
Næste artikelHvorfor kan en katalysator fremskynde reaktion, selv ved lav temperatur?
 Varme artikler
Varme artikler
-
 Forudsigelse af forvrængning og ydeevne af dele fremstillet ved additiv fremstillingKredit:CC0 Public Domain Undersøgelser af de resterende spændinger, der dannes under en additiv fremstillingsproces (AM) har afsløret, at bygningsorienteringen af den del, der produceres, har en
Forudsigelse af forvrængning og ydeevne af dele fremstillet ved additiv fremstillingKredit:CC0 Public Domain Undersøgelser af de resterende spændinger, der dannes under en additiv fremstillingsproces (AM) har afsløret, at bygningsorienteringen af den del, der produceres, har en -
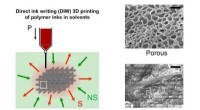 Forskere udvikler en unik metode til fremstilling af 3-D porøse strukturerKoncept for ip3DP - En polymeropløsning printes af en DIW 3D-printer i et ikke-opløsningsmiddel. Den trykte genstand størkner via nedsænkning, og den trykte genstand bibringes porøsitet. Kredit:SUTD
Forskere udvikler en unik metode til fremstilling af 3-D porøse strukturerKoncept for ip3DP - En polymeropløsning printes af en DIW 3D-printer i et ikke-opløsningsmiddel. Den trykte genstand størkner via nedsænkning, og den trykte genstand bibringes porøsitet. Kredit:SUTD -
 XenonPy.MDL:Et omfattende bibliotek af fortrænede modeller til materialeegenskaberTermofysiske egenskaber (dvs. termisk ledningsevne) af polymerer forudsagt af transfer learning (TL). Den fælles forskergruppe lykkedes med at konstruere en maskinlæringsmodel, der er i stand til ekst
XenonPy.MDL:Et omfattende bibliotek af fortrænede modeller til materialeegenskaberTermofysiske egenskaber (dvs. termisk ledningsevne) af polymerer forudsagt af transfer learning (TL). Den fælles forskergruppe lykkedes med at konstruere en maskinlæringsmodel, der er i stand til ekst -
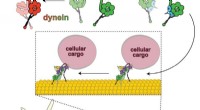 Biokemikere afslører molekylær mekanisme til motorisk proteinreguleringlissencephaly-1, eller Lis1 protein, aktiverer dynein-motoren, så den kan transportere cellulær last. Dyneinen skifter mellem off (venstre) og on (højre). Lis1 binder til dynein, når den er tændt, for
Biokemikere afslører molekylær mekanisme til motorisk proteinreguleringlissencephaly-1, eller Lis1 protein, aktiverer dynein-motoren, så den kan transportere cellulær last. Dyneinen skifter mellem off (venstre) og on (højre). Lis1 binder til dynein, når den er tændt, for
- Store oversvømmelser steg i tempererede klimaer, men faldt andre steder
- Fordelene ved Heap Sort
- Hvad er Alumanodi?
- Hvad etiketter på tekstiler kan fortælle os om samfundet
- All-optisk objektidentifikation og tredimensionel rekonstruktion baseret på optisk computermetasurf…
- Undersøgelse afslører, hvordan bakterier kommunikerer i grupper for at undgå antibiotika


