Biokemikere afslører molekylær mekanisme til motorisk proteinregulering

lissencephaly-1, eller Lis1 protein, aktiverer dynein-motoren, så den kan transportere cellulær last. Dyneinen skifter mellem "off" (venstre) og "on" (højre). Lis1 binder til dynein, når den er tændt, forhindre dynein i at skifte til en "off" tilstand. Kredit:Markus Lab/Colorado State University
Bevægelse signalerer liv, og ingen steder er dette mere sandt end inde i en levende celle. De millioner af proteiner og molekyler i hver af vores celler bøjer sig, rejse og tilpasse sig i et komplekst, men orkestreret mønster, reguleret af de gener, der koder for, hvad der går hvor og hvornår. Som en del af det mønster, en vigtig klasse af proteiner kaldet dynein transporterer og leverer forskellige cellulære laster mellem forskellige områder af cellen.
Colorado State University biokemiforsker Steven Markus er særligt fascineret af disse store, intracellulære motoriske proteiner, der bevæger sig metodisk langs et netværk af filamentøse spor kaldet mikrotubuli.
Hvor vigtigt er dynein? Hvis dynein skulle forsvinde, vi ville ikke leve forbi et par mitotiske celledelinger. Og mange neurologiske sygdomme, inklusive en kaldet lissencephaly, er forbundet med defekter i dynein-funktionen. Målet for mange laboratorier, inklusive Markus', er at forstå hvorfor.
Hans forskerhold har taget et spring i denne forståelse ved at afsløre, i indviklede detaljer, den mekanisme, hvorved et bestemt molekyle påvirker dyneinfunktionen. Mens det længe var kendt, at lissencephaly-1-genet, eller Lis1, påvirker dynein aktivitet, detaljerne var uklare. Markus og hans team har afsløret præcis, hvordan Lis1 aktiverer dynein ved at forhindre dyneins evne til at slukke for sig selv, stabilisere det i en "åben, "uhæmmet konformation.
Det nye fund er i modstrid med tidligere accepterede synspunkter om, at Lis1 virkede som en hæmmer af dynein. Ifølge Markus labs nye undersøgelse, udgivet 27. april i Naturens cellebiologi , det stik modsatte er sandt:Lis1 aktiverer dynein, arbejder på at kile sig fast på en sådan måde, at motorproteinet forhindres i at folde sig selv til en "off"-tilstand - hvilket hæmmer dets evne til at auto-inhibere, forklarer forskerne.
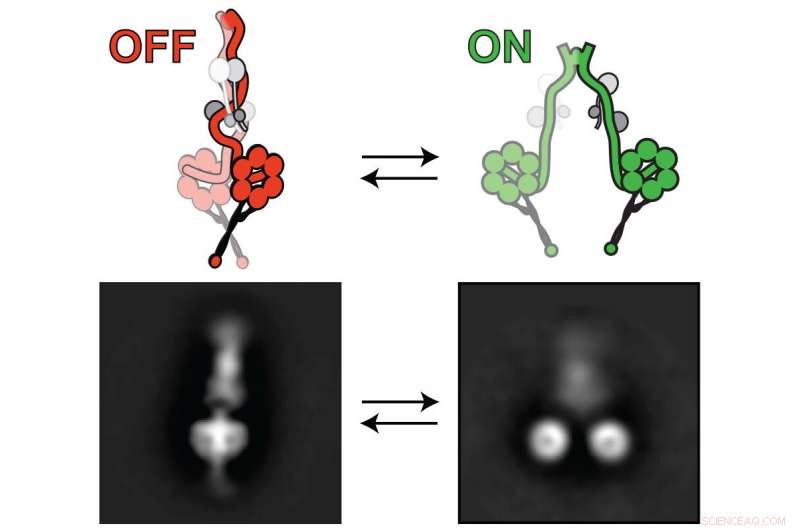
Forskerne brugte en kombination af banebrydende teknikker til at drage deres konklusioner, herunder højopløsnings elektronmikroskopi. De brugte dette til at visualisere dynein-motoren i dens "off" (venstre) og "on" (højre) tilstande. Kredit:Markus Lab/Colorado State University
Forståelse af det molekylære grundlag for sygdom
En person med lissencefali, eller "glat hjerne, " lider af anfald og begrænset motorisk funktion og lever sjældent efter et par år. Denne ødelæggende sygdom er forbundet med en mutation i Lis1, et gen, der koder for en kritisk regulator af dynein.
"Jeg er interesseret i det molekylære grundlag for disse sygdomme, sagde Markus, adjunkt ved Institut for Biokemi og Molekylærbiologi. "Der vil ikke være nogen terapeutiske indgreb uden at forstå, hvordan disse molekyler fungerer." Udover det, Markus siger, "molekylære motorer er sjove, fordi vi kan rense disse motorer og se dem gå på mikrotubuli i realtid ved hjælp af fluorescensmikroskopi" - hvilket er præcis, hvad holdet gjorde for deres undersøgelse.
For at udføre deres eksperimenter, forskerne brugte spirende gærceller som et modelsystem. I modsætning til menneskeceller, hvor dynein udfører adskillige aktiviteter, dynein udfører kun en enkelt funktion i disse celler. Deres resultater med dette forenklede system kan omsættes til menneskelige og andre højere eukaryote celler, hvor grundlæggende dynein-funktion er bevaret gennem millioner af års evolution.
Forskerne brugte flere teknikker til at drage deres konklusioner. Den vigtigste var real-time enkelt-molekyle billeddannelse. Ved at bruge en højtydende teknik, de udviklede i laboratoriet, holdet rensede dynein, tilføjet et fluorescerende molekyle, og sammensatte mikroskop-billeddannelseskamre med rensede mikrotubuli for at se dyneinen "glippe sammen, " sagde Markus. Denne teknik gjorde det muligt for dem at fastslå rollen af den auto-hæmmede konformation i dynein-motiliteten.
De brugte også elektronmikroskopi til at tage meget højopløselige stillbilleder for at afgøre, om dynein-molekylerne faktisk antog en auto-hæmmet konformation, hvilket var uklart, da de begyndte deres studie. "På dag et på elektronmikroskopianlægget, vi var meget overraskede over at se, at dynein-molekylerne var utvetydigt i en auto-hæmmet konformation, " sagde Markus. "Den havde den meget distinkte form."
Studiets hovedforfatter var tidligere kandidatstuderende Matthew Marzo (nu postdoktor ved Columbia University), der har designet og ledet eksperimenterne, med assistance fra medforfatter og daværende bachelorstuderende Jacqueline Griswold (nu ph.d.-studerende og NSF-kandidatforsker ved Johns Hopkins School of Medicine).
Markus planlægger at udføre andre eksperimenter, bruger de samme gærceller, for yderligere at undersøge Lis1's rolle i, hvad han og kolleger mener er en flertrins-vej, der aktiverer dynein. Han håber også at arbejde sammen med neurovidenskabsmænd ved CSU for at afgøre, om Lis1-aktiveringsmekanismen fungerer på samme måde i neuroner. der, Målet vil være at give endnu mere viden om, hvordan hjernesygdomme som lissencephaly opstår på molekylært niveau.
Undersøgelsen har titlen:"Pac1/LIS1 stabiliserer en uhæmmet konformation af dynein for at koordinere dets lokalisering og aktivitet."
 Varme artikler
Varme artikler
-
 Sådan Identificeres Dele af et AtomVi ved nu ganske lidt om atomets indre, den grundlæggende byggesten af naturen. Der er blot nogle få grundlæggende dele af et atom, og mens det ville være svært for den gennemsnitlige person faktisk
Sådan Identificeres Dele af et AtomVi ved nu ganske lidt om atomets indre, den grundlæggende byggesten af naturen. Der er blot nogle få grundlæggende dele af et atom, og mens det ville være svært for den gennemsnitlige person faktisk -
 Fordøjelse af kulbrinterRebecca Caravan, Sandia National Laboratories postdoc ansat, justerer Sandia Multiplexed Photoionization Mass Spectrometer, der blev brugt til at udføre forskning på flygtige organiske forbindelser. K
Fordøjelse af kulbrinterRebecca Caravan, Sandia National Laboratories postdoc ansat, justerer Sandia Multiplexed Photoionization Mass Spectrometer, der blev brugt til at udføre forskning på flygtige organiske forbindelser. K -
 Forskere udvikler nye molekylære ferroelektriske metamaterialer3-D-printet molekylært ferroelektrisk metamateriale lavet af imidazoliumperchlorat. Kredit:University at Buffalo Et forskerhold ledet af universitetet i Buffalo har rapporteret om et nyt 3-D-print
Forskere udvikler nye molekylære ferroelektriske metamaterialer3-D-printet molekylært ferroelektrisk metamateriale lavet af imidazoliumperchlorat. Kredit:University at Buffalo Et forskerhold ledet af universitetet i Buffalo har rapporteret om et nyt 3-D-print -
 Små implantater til celler er funktionelle in vivoKunstige organeller i scavenger-cellerne hos en zebrafisk, der blev gjort synlige ved en fluorescerende reaktion. Fluorescensen opstår kun, når det indesluttede peroxidaseenzym aktiveres og reagerer m
Små implantater til celler er funktionelle in vivoKunstige organeller i scavenger-cellerne hos en zebrafisk, der blev gjort synlige ved en fluorescerende reaktion. Fluorescensen opstår kun, når det indesluttede peroxidaseenzym aktiveres og reagerer m
- FN bekræfter rekordvarme på 18,3C i Antarktis
- Risici ved at manipulere den globale termostat
- Forskere realiserer real-time GW-BSE undersøgelser af spin-dal exciton dynamik
- Var disse eksperimentresultater virkelig så forudsigelige? Disse forskere sigter efter at finde ud …
- Sådan konverteres Rockwell-hårdhed til trækstyrke
- Forskning viser, at landskaber i det centrale Texas kan blive tørstige, men stadig trives


