Hvad har typen af binding i metaller at gøre med deres elastiske plastiske termiske og elektriske opførsel?
Metallisk binding:
* delokaliserede elektroner: Ved metallisk binding er valenselektronerne af metalatomer ikke bundet til noget specifikt atom, men er frie til at bevæge sig gennem hele metalgitteret. Disse delokaliserede elektroner danner et "hav" af elektroner, der holder de positivt ladede metalioner sammen.
Elasticitet:
* metalatomer kan skifte lidt: De delokaliserede elektroner tillader metalatomerne at bevæge sig lidt fra deres ligevægtspositioner, hvilket giver en grad af fleksibilitet. Dette er grunden til, at metaller kan bøjes eller strækkes uden at bryde og udviser elastisk opførsel.
* Vend tilbage til original form: Når stresset fjernes, trækker de stærke elektrostatiske kræfter mellem ionerne og elektronhavet atomerne tilbage til deres oprindelige positioner, hvilket får metallet til at vende tilbage til sin oprindelige form.
plasticitet:
* Permanent deformation: Hvis den stress, der påføres et metal, overstiger dens elastiske grænse, forskydes atomerne for langt til at vende tilbage til deres oprindelige positioner. Dette resulterer i permanent deformation eller plasticitet.
* dislokationer: Denne deformation forekommer ofte gennem bevægelsen af "dislokationer", defekter i krystalgitteret, der giver atomer mulighed for at bevæge sig forbi hinanden lettere.
Termisk opførsel:
* gode varmeledere: De delokaliserede elektroner er frie til at bære termisk energi gennem metallet, hvilket gør det til en fremragende leder af varme.
* høje smelte- og kogepunkter: Den stærke metalliske binding kræver en stor mængde energi til at bryde, hvilket resulterer i høje smelte- og kogepunkter for de fleste metaller.
Elektrisk adfærd:
* Fremragende elektriske ledere: De frit bevægende elektroner i elektronhavet kan let bære en elektrisk strøm, hvilket gør metaller fremragende elektriske ledere.
* modstand: Mens metaller udfører elektricitet meget godt, har de en vis modstand mod strømmen af elektroner på grund af kollisioner mellem elektronerne og metalionerne. Denne modstand øges med temperaturen.
Sammendrag:
Den unikke karakter af metallisk binding med dens delokaliserede elektroner og stærke elektrostatiske interaktioner er ansvarlig for de karakteristiske egenskaber ved metaller, inklusive deres:
* Elasticitet: Evne til at deformere under stress og vende tilbage til original form.
* plasticitet: Evne til at deformere permanent under stress.
* Termisk ledningsevne: Evne til at overføre varme effektivt.
* Elektrisk ledningsevne: Evne til at udføre elektricitet effektivt.
Disse egenskaber gør metaller værdifulde materialer i en lang række applikationer, fra konstruktion og teknik til elektronik og smykker.
Sidste artikelHvilken væske blev brugt i Twinkies -projektet?
Næste artikelHvor opnås akryl fra?
 Varme artikler
Varme artikler
-
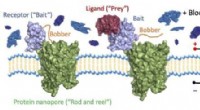 Forskere udvikler molekylær fiskeri for at finde individuelle molekyler i blodDenne figur illustrerer en protein-nanopore-baseret sensor til påvisning af proteiner i en kompleks biologisk væske ved enkeltmolekylær præcision. På venstre side, sensoren, som er et konstrueret tran
Forskere udvikler molekylær fiskeri for at finde individuelle molekyler i blodDenne figur illustrerer en protein-nanopore-baseret sensor til påvisning af proteiner i en kompleks biologisk væske ved enkeltmolekylær præcision. På venstre side, sensoren, som er et konstrueret tran -
 Udnyttelse af molekylære vibrationer til at syntetisere ledende polymererTo typer bisanthenpolymerer syntetiseret på en guldoverflade med atomær præcision. Kredit:CC-BY Nat. Commun. 11, 4567 (2020). Konjugerede polymerer er organiske makromolekyler, der er karakteriser
Udnyttelse af molekylære vibrationer til at syntetisere ledende polymererTo typer bisanthenpolymerer syntetiseret på en guldoverflade med atomær præcision. Kredit:CC-BY Nat. Commun. 11, 4567 (2020). Konjugerede polymerer er organiske makromolekyler, der er karakteriser -
 Ny polymer kan øge ydeevnen af organiske og perovskit-solcellerVariation på forsiden af Macromolecular Chemistry and Physics-udgaven med undersøgelsen rapporteret i denne historie, begge kunstværker af undersøgelsens første forfatter. Kredit:Marina Tepliakova/S
Ny polymer kan øge ydeevnen af organiske og perovskit-solcellerVariation på forsiden af Macromolecular Chemistry and Physics-udgaven med undersøgelsen rapporteret i denne historie, begge kunstværker af undersøgelsens første forfatter. Kredit:Marina Tepliakova/S -
 Ny metode eliminerer interferens af nikotin ved påvisning af metamfetaminIonmobilitetsspektre for metamfetamin, nikotin, og deres blanding uden (venstre) og med dopet pyridin (højre). Kredit:XIA Lei For nylig, en forskergruppe ledet af Chu Yannan og Huang Chaoqun fra I
Ny metode eliminerer interferens af nikotin ved påvisning af metamfetaminIonmobilitetsspektre for metamfetamin, nikotin, og deres blanding uden (venstre) og med dopet pyridin (højre). Kredit:XIA Lei For nylig, en forskergruppe ledet af Chu Yannan og Huang Chaoqun fra I
- Hvordan udviklede sproget sig?
- Store ældgamle flyveløse fugle fra Australien, Europa og Nordamerika viste sig at være beslægted…
- Effekter af ændringer i materialer på miljøet?
- Hvad er nogle videnskabelige projektemner, som en gymnasiestudent kan vælge?
- Steam, hvordan motorer fungerer
- Hvordan græsbuffere holder landbrugsherbicider i skak


