Hvorfor opløses en mættet salt, når den opvarmes?
* opløselighed: Opløselighed er den maksimale mængde af et stof (opløst), der kan opløses i en given mængde opløsningsmiddel ved en bestemt temperatur. For de fleste faste stoffer, som salt, øges opløseligheden med temperaturen.
* mættet: En mættet opløsning betyder, at opløsningsmidlet (vand) har opløst så meget opløst stof (salt), som det muligvis kan ved den temperatur.
* Opvarmning af en mættet løsning: Når du opvarmer en mættet saltopløsning, øger du i det væsentlige opløselighedsgrænsen. Løsningen har nu kapacitet til at opløse mere salt, men det betyder ikke, at det allerede opløste salt forsvinder.
Her er en bedre måde at tænke over det på:
1. kold løsning: Du har en mættet opløsning af salt i koldt vand. Alt det salt, der kunne opløses ved denne temperatur, er allerede opløst.
2. Opvarmning af løsningen: Du øger temperaturen. Dette øger opløselighedsgrænsen, hvilket betyder, at mere salt * kunne * opløses, hvis den var til stede.
3. ikke mere opløst: Da opløsningen allerede er mættet, er der ikke mere salt at opløses, selvom opløselighedsgrænsen er steget.
4. Tilføjelse af mere salt: Hvis du tilsætter mere salt til den opvarmede mættede opløsning, opløses noget af den, fordi opløselighedsgrænsen er hævet. Løsningen er ikke længere mættet, men den vil til sidst blive mættet igen, hvis du fortsætter med at tilføje salt.
I det væsentlige forårsager opvarmning af en mættet saltopløsning ikke, at det opløste salt opløses yderligere. Det øger simpelthen løsningens kapacitet til at opløse * mere * salt, hvis du tilføjer den.
Sidste artikelHvilken plante producerer syrer, der hjælper med kemisk forvitring?
Næste artikelEr NMR en opløsningsmiddelekstraktionsteknik?
 Varme artikler
Varme artikler
-
 Titan-i-et-glas-eksperimenter antyder mineralsammensætning af Saturn-månenÆgte farvebillede af lag af dis i Titans atmosfære. Kredit:NASA Titan, Saturns største måne, er et naturligt laboratorium til at studere livets oprindelse. Ligesom Jorden, Titan har en tæt atmosfæ
Titan-i-et-glas-eksperimenter antyder mineralsammensætning af Saturn-månenÆgte farvebillede af lag af dis i Titans atmosfære. Kredit:NASA Titan, Saturns største måne, er et naturligt laboratorium til at studere livets oprindelse. Ligesom Jorden, Titan har en tæt atmosfæ -
 Kan sollys omdanne emissioner til nyttige materialer?Kredit:Pixabay/CC0 Public Domain Shaama Sharada kalder kuldioxid - den værste lovovertræder af den globale opvarmning - en meget stabil, meget glad molekyle. Det vil hun ændre på. For nylig off
Kan sollys omdanne emissioner til nyttige materialer?Kredit:Pixabay/CC0 Public Domain Shaama Sharada kalder kuldioxid - den værste lovovertræder af den globale opvarmning - en meget stabil, meget glad molekyle. Det vil hun ændre på. For nylig off -
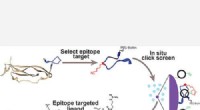 Bærbare sensorer kunne udnytte bioteknologi til at overvåge personlige, miljødataHurtig udviklingsproces af billig, meget stabile og modulære peptidbaserede syntetiske affinitetsmidler (PCCer) til proteinmål gennem brug af store peptidbiblioteker. Kredit:Genoptrykt med tilladelse
Bærbare sensorer kunne udnytte bioteknologi til at overvåge personlige, miljødataHurtig udviklingsproces af billig, meget stabile og modulære peptidbaserede syntetiske affinitetsmidler (PCCer) til proteinmål gennem brug af store peptidbiblioteker. Kredit:Genoptrykt med tilladelse -
 Ny teknik bringer studiet af molekylær konfiguration ind i det mikroskopiske domæneRohit Bhargava med postdoktor Kevin Yeh, der designede det brugerdefinerede infrarøde mikroskop, der blev brugt til denne undersøgelse. Dette foto er taget i februar 2020. Kredit:L. Brian Stauffer, Un
Ny teknik bringer studiet af molekylær konfiguration ind i det mikroskopiske domæneRohit Bhargava med postdoktor Kevin Yeh, der designede det brugerdefinerede infrarøde mikroskop, der blev brugt til denne undersøgelse. Dette foto er taget i februar 2020. Kredit:L. Brian Stauffer, Un
- Er klasse Agnatha endotermisk eller økoterm?
- Google, Facebook, Amazon afviser fransk digital skat som diskriminerende
- Hvordan verdens mest præcise ur kunne transformere fundamental fysik
- Hvorfor roterer Mælkevejen?
- Hvor varmt er en brand i Celsius?
- Fokuserede røntgenstråler afslører, hvordan sten under højt tryk omdannes til forskellige materi…


