Hvilken familie i den periodiske tabel indeholder de fleste reaktive metaller?
Her er hvorfor:
* Elektronkonfiguration: Alkalimetaller har kun en valenselektron (elektron i den yderste skal). Denne enkelt elektron går let tabt, hvilket gør dem meget reaktive.
* Elektropositivitet: De er meget elektropositive, hvilket betyder, at de let mister deres valenselektron for at danne positive ioner.
* ioniseringsenergi: De har lave ioniseringsenergier, hvilket betyder, at det kræver relativt lidt energi at fjerne valenselektronen.
Eksempler på alkalimetaller:
* Lithium (Li)
* Natrium (NA)
* Kalium (k)
* Rubidium (RB)
* Cesium (CS)
* Francium (FR)
Husk, at reaktiviteten øges, når du bevæger dig ned ad alkalimetalgruppen. Dette skyldes, at valenselektronen er længere væk fra kernen og lettere at fjerne.
 Varme artikler
Varme artikler
-
 Et skridt nærmere produktion af miljøvenlig brintbrændstofKredit:CC0 Public Domain Griffith University-forskere sigter mod at låse op for en katalytisk proces, der vil forbedre nedbrydningen af vand, til brint og oxygen og bringe Australien et skridt t
Et skridt nærmere produktion af miljøvenlig brintbrændstofKredit:CC0 Public Domain Griffith University-forskere sigter mod at låse op for en katalytisk proces, der vil forbedre nedbrydningen af vand, til brint og oxygen og bringe Australien et skridt t -
 Løsning af problemet:Organisk damp inducerer opløsning af molekylære salteForskere fra Institute of Industrial Science, University of Tokyo, finder ud af, at organiske dampe kan inducere opløsning af molekylære salte (dvs. organisk delikvence), svarende til vanddamp-inducer
Løsning af problemet:Organisk damp inducerer opløsning af molekylære salteForskere fra Institute of Industrial Science, University of Tokyo, finder ud af, at organiske dampe kan inducere opløsning af molekylære salte (dvs. organisk delikvence), svarende til vanddamp-inducer -
 Samtidig emission af ortogonal handedness i cirkulær polariseringen, skematiske diagrammer af fremstillingsprocessen af den cirkulære polarisations-emitterende enhed (dvs. den 1. gnidning af AL22636 belagt på CuPc. ii, spin coating og tørring af F8BT lag og iii,
Samtidig emission af ortogonal handedness i cirkulær polariseringen, skematiske diagrammer af fremstillingsprocessen af den cirkulære polarisations-emitterende enhed (dvs. den 1. gnidning af AL22636 belagt på CuPc. ii, spin coating og tørring af F8BT lag og iii, -
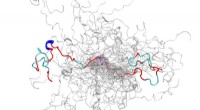 Supercomputing, neutroner forenes for at optrevle strukturer af iboende forstyrret proteinKonfigurationsensemblet (en samling af 3D-strukturer) af et iboende forstyrret protein, N-terminalen af c-Src kinase, som er et vigtigt signalprotein hos mennesker. Kredit:Oak Ridge National Laborat
Supercomputing, neutroner forenes for at optrevle strukturer af iboende forstyrret proteinKonfigurationsensemblet (en samling af 3D-strukturer) af et iboende forstyrret protein, N-terminalen af c-Src kinase, som er et vigtigt signalprotein hos mennesker. Kredit:Oak Ridge National Laborat
- Hvis du stoler på politikere og videnskabsmænd, så distancerer du dig sandsynligvis socialt
- Stabile nanovesikler til levering af mikroRNA i kræftbehandling
- Mød zombiemyresvampen, der inspirerede HBO'er The Last of Us
- Folk i de pro-Trump-dele af USA blev mindre hjemme og fik COVID mere
- Hvad betyder Wall Streets genopretning for Main Street?
- Hvad kan en organisme gøre, mens han bor i organisme?


