Hvorfor er selendioxid fast ved stuetemperatur, mens svovl en gas?
* molekylær struktur og binding:
* selen -dioxid (SEO₂): Findes som et fast stof, fordi det har en diskret molekylstruktur med stærke kovalente bindinger mellem selen- og iltatomer. Denne struktur giver mulighed for intermolekylære kræfter som dipol-dipol-interaktioner, som er relativt stærke og holder molekylerne tæt pakket sammen i et solidt gitter.
* svovl (r): Findes som en gas, fordi den danner ringe eller kæder af svovlatomer forbundet med enkeltbindinger. Disse ringe og kæder er meget svagere end de kovalente bindinger i SEO₂. De intermolekylære kræfter mellem disse svovlmolekyler er meget svage, hvilket resulterer i en gasformig tilstand ved stuetemperatur.
* molekylvægt og størrelse:
* selen -dioxid (SEO₂): Har en højere molekylvægt og en mere kompleks struktur sammenlignet med svovl. Dette bidrager til stærkere intermolekylære kræfter og et højere smeltepunkt.
* svovl (r): Har en lavere molekylvægt og enklere struktur. De svagere kræfter mellem svovlmolekyler gør det lettere at bryde bindingerne og eksisterer i en gasformig tilstand ved stuetemperatur.
* Polaritet:
* selen -dioxid (SEO₂): Er et polært molekyle på grund af elektronegativitetsforskellen mellem selen- og iltatomer. Denne polaritet styrker de intermolekylære kræfter og bidrager til dens solide tilstand.
* svovl (r): Er et ikke -polært molekyle, hvilket betyder, at det har svage intermolekylære kræfter, hvilket yderligere bidrager til dens gasformige tilstand ved stuetemperatur.
I det væsentlige resulterer de stærkere intermolekylære kræfter og den mere komplekse struktur i selendioxid i et højere smeltepunkt og dets faste tilstand ved stuetemperatur. Omvendt fører svovls svage intermolekylære kræfter og enklere struktur til et lavere smeltepunkt og en gasformig tilstand ved stuetemperatur.
Sidste artikelHvad ville du bruge acetone som rengøringsmiddel?
Næste artikelHvad er arrangementet af subatomære partikler i 14c?
 Varme artikler
Varme artikler
-
 Ny metode kan effektivt skabe flere byggesten af farmaceutiske lægemidlerEn ny metode, der lover at fremskynde forskning i lægemidler til flere sygdomme. Kredit:Waseda University Flere lægemidler, herunder dem til depression, skizofreni, og malaria, ville ikke eksister
Ny metode kan effektivt skabe flere byggesten af farmaceutiske lægemidlerEn ny metode, der lover at fremskynde forskning i lægemidler til flere sygdomme. Kredit:Waseda University Flere lægemidler, herunder dem til depression, skizofreni, og malaria, ville ikke eksister -
 Kemiker udvikler syntesemetode for 28 biologisk aktive molekylerKredit:RUDN Universitet RUDN Universitetskemiker Erik Van der Eycken har fundet frem til en ny metode til syntese af en stor gruppe komplekse poly-heterocykliske organiske forbindelser, som kan ha
Kemiker udvikler syntesemetode for 28 biologisk aktive molekylerKredit:RUDN Universitet RUDN Universitetskemiker Erik Van der Eycken har fundet frem til en ny metode til syntese af en stor gruppe komplekse poly-heterocykliske organiske forbindelser, som kan ha -
 Forskere udtænker en ny metode til at få bly ud af filtre, bedre måle mængden i postevandForskere i laboratoriet af Daniel Giammar, Walter E. Browne professor i miljøteknik i McKelvey School of Engineering, har udtænkt en ny metode, der giver dem mulighed for at udtrække bly fra point-of-
Forskere udtænker en ny metode til at få bly ud af filtre, bedre måle mængden i postevandForskere i laboratoriet af Daniel Giammar, Walter E. Browne professor i miljøteknik i McKelvey School of Engineering, har udtænkt en ny metode, der giver dem mulighed for at udtrække bly fra point-of- -
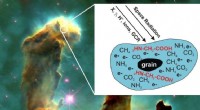 Hvordan livets byggesten kan dannes i rummetElektroner med lav energi skabt i stof af rumstråling (f.eks. galaktiske kosmiske stråler, GCR, etc.), kan inducere dannelse af glycin (2HN-CH2-COOH) i astrofysiske molekylære iser; her, iskolde korn
Hvordan livets byggesten kan dannes i rummetElektroner med lav energi skabt i stof af rumstråling (f.eks. galaktiske kosmiske stråler, GCR, etc.), kan inducere dannelse af glycin (2HN-CH2-COOH) i astrofysiske molekylære iser; her, iskolde korn
- Hvad er bane af en planet omkring solen a (n)?
- Mount St. Helens udbrud
- Storstilet undersøgelse viser ny, rigelige nitrogenfikserende mikrober i overfladehav
- Hvad er en PIC -chip?
- Fanget på fersk gerning:MeerKAT-teleskopet spionerer stjerneblus
- Faseovergang kubisk galliumnitrid fordobler ultraviolet emissionseffektivitet


