Hvad er PKA i kemi?
pka:et mål for surhed
pka er et grundlæggende koncept inden for kemi, der kvantificerer surhedsgraden af et molekyle . Det er en logaritmisk skala, der beskriver en tendens til et molekyle til at donere en proton (H+).
Her er en sammenbrud:
* surhed: Hvor let et molekyle donerer en proton (H+) til en opløsning.
* ka (surhedsgrad): Et mål for ligevægtskonstanten til dissociation af en syre i opløsning.
* pka: Den negative logaritme (base 10) af Ka -værdien.
i enklere termer:
* Lav PKA: Angiver en stærk syre (mere tilbøjelig til at donere en proton).
* Høj PKA: Angiver en svag syre (mindre tilbøjelig til at donere en proton).
Her er en visuel analogi:
Tænk på PKA som en stige. Jo stærkere syren er, jo lavere sidder den på stigen (nedre PKA). Jo svagere syren er, jo højere sidder den på stigen (højere PKA).
Nøglepunkter om PKA:
* pH og PKA: PH af en opløsning er relateret til syrens PKA i den. PH vil være lig med PKA, når syren er halvt dissocieret.
* buffere: Buffere er opløsninger, der modstår ændringer i pH. De består typisk af en svag syre og dens konjugatbase, hvor syrens PKA er tæt på den ønskede pH.
* Biologisk betydning: PKA spiller en afgørende rolle i biologiske systemer, der påvirker opførelsen af proteiner, enzymer og DNA.
Eksempler:
* saltsyre (HCL): PKA =-7 (meget stærk syre)
* eddikesyre (CH3COOH): PKA =4,75 (svag syre)
* vand (H2O): PKA =15,7 (meget svag syre)
Konklusion:
PKA er et kraftfuldt værktøj til forståelse og forudsigelse af opførsel af syrer og baser i opløsning. Det har brede anvendelser inden for forskellige områder, herunder kemi, biologi, medicin og miljøvidenskab.
Sidste artikelHvad producerer hydrolyse af en ketal?
Næste artikelHvad er partikelteorien om stof til vandkogning?
 Varme artikler
Varme artikler
-
 Kompleks liv udviklede sig ud af den tilfældige kobling af små molekylerEt simpelt RNA-molekyle som dette kan have været ansvarlig for udviklingen af komplekst liv, som vi kender det. Kredit:Wits University Kompleks liv, som vi kender det, startede helt tilfældigt,
Kompleks liv udviklede sig ud af den tilfældige kobling af små molekylerEt simpelt RNA-molekyle som dette kan have været ansvarlig for udviklingen af komplekst liv, som vi kender det. Kredit:Wits University Kompleks liv, som vi kender det, startede helt tilfældigt, -
 Rammediversitet af carbonnitrider tilbyder rig platform for enkeltatoms katalyseOptimerede Pd-koordinationssteder inden for forskellige kulnitridstilladser med 6N, 9N, og 15N lommer. Værdier i parentes under hvert billede angiver de tilsvarende formationsenergier (venstre), bereg
Rammediversitet af carbonnitrider tilbyder rig platform for enkeltatoms katalyseOptimerede Pd-koordinationssteder inden for forskellige kulnitridstilladser med 6N, 9N, og 15N lommer. Værdier i parentes under hvert billede angiver de tilsvarende formationsenergier (venstre), bereg -
 Kontrolleret dynamik af kolloide stængerModel af kolloide stænger af forskellig længde, som bevæger sig som skakbrikker på en magnetiseret chip. Kredit:Adrian Ernst. Kolloide partikler er blevet stadig vigtigere for forskning som bærere
Kontrolleret dynamik af kolloide stængerModel af kolloide stænger af forskellig længde, som bevæger sig som skakbrikker på en magnetiseret chip. Kredit:Adrian Ernst. Kolloide partikler er blevet stadig vigtigere for forskning som bærere -
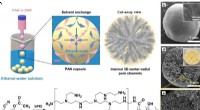 Ny teknologi øger dramatisk genindvindingsgraden af ædle metaller fra affaldFremstillingsprocessen og de fysiske/kemiske strukturer af guldgenvindingsmateriale. Kredit:Korea Institute of Science and Technology (KIST) I Sydkorea, som er afhængig af import for 99,3 % af sine
Ny teknologi øger dramatisk genindvindingsgraden af ædle metaller fra affaldFremstillingsprocessen og de fysiske/kemiske strukturer af guldgenvindingsmateriale. Kredit:Korea Institute of Science and Technology (KIST) I Sydkorea, som er afhængig af import for 99,3 % af sine
- Billede:Hubble ser galaksen NGC 5728
- Slange-inspireret robot glider endnu bedre end forgængeren
- Sådan beregnes PH af pufferløsninger
- Indvoldene på en Apple iPhone viser præcis, hvad Trump tager fejl af handel
- Sekundære skove har kort levetid
- Opløsningsmiddel pH kontrollerer interaktioner af guld nanoclusters, tilbyder potentielle anvendels…


