Hvorfor findes jernioner ikke i opløsning?
Ferriske ioner do eksisterer i løsning, men de er meget reaktive og har en tendens til hydrolyser (reagerer med vand) for at danne forskellige arter, herunder hydratiserede jernioner , hydroxo -komplekser og udfældede jernhydroxider .
Her er en sammenbrud:
* Hydrolyse: I vandig opløsning reagerer Fe³⁺ -ioner let med vandmolekyler, accepterer elektroner og danner hydratiserede ioner som [Fe (H₂O) ₆] ³⁺. Denne proces kaldes også akvation .
* hydroxo -komplekser: Yderligere reaktion med vand kan føre til dannelse af hydroxo -komplekser, såsom [Fe (OH) (H₂O) ₅] ²⁺, [Fe (OH) ₂ (H₂O) ₄] ⁺, og så videre.
* nedbør: Ved højere pH -værdier kan hydroxo -komplekserne yderligere reagere på dannelse af uopløselige jernhydroxider (Fe (OH) ₃), der udfælder ud af opløsningen.
Derfor, selvom frie Fe³⁺ -ioner kan være til stede i meget lave koncentrationer, er de ikke de dominerende arter i opløsning. I stedet findes de for det meste i form af hydrerede ioner, hydroxo -komplekser eller bundfald.
Eksistensen af ferriske ioner i opløsning er afhængig af faktorer som:
* ph: Lavere pH -værdier favoriserer eksistensen af hydratiserede ferrierioner, mens højere pH -værdier fremmer dannelsen af hydroxo -komplekser og bundfald.
* Koncentration: Ved lave koncentrationer er hydrolyseprocessen mindre signifikant.
* ligander: Tilstedeværelsen af andre ligander (molekyler eller ioner, der binder til metalion) kan påvirke speciation af jernioner.
Det er vigtigt at bemærke, at udtrykket "ferriske ioner" ofte bruges løst til at henvise til de forskellige arter, der findes i opløsning, herunder hydratiserede ioner, hydroxo -komplekser og udfældning. Det er dog vigtigt at huske, at størstedelen af jern i opløsning ikke er til stede som frie fe³⁺ioner.
Sidste artikelEr mad fysisk ejendom og kemisk ejendom?
Næste artikelHvad er 5,25 atomer af chlorid, hvor mange mol?
 Varme artikler
Varme artikler
-
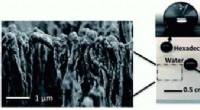 En skov af nanosvampestrukturer holder denne plast ren og pletfriKredit: Journal of Materials Chemistry A (2019). DOI:10.1039/C9TA01753D Teknologier som solpaneler og lysdioder kræver et dækmateriale, der afviser vand, snavs og olie, mens den stadig slipper ma
En skov af nanosvampestrukturer holder denne plast ren og pletfriKredit: Journal of Materials Chemistry A (2019). DOI:10.1039/C9TA01753D Teknologier som solpaneler og lysdioder kræver et dækmateriale, der afviser vand, snavs og olie, mens den stadig slipper ma -
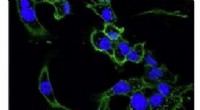 Polymer afledt af materiale i rejeskaller kunne levere anti-cancermedicin til tumorstederDisse billeder viser brystkræftceller fra mus taget under et mikroskop. På begge billeder grøn angiver cellemembranen, og blå angiver kernen. Celler i det nederste billede er blevet behandlet med Taxo
Polymer afledt af materiale i rejeskaller kunne levere anti-cancermedicin til tumorstederDisse billeder viser brystkræftceller fra mus taget under et mikroskop. På begge billeder grøn angiver cellemembranen, og blå angiver kernen. Celler i det nederste billede er blevet behandlet med Taxo -
 Uventet nyt materiale er slukket til omgivelsestrykAlena Ponomareva og Igor Abrikosov, forfattere fra NUST MISIS diskuterer de grafiske resultater af den teoretiske modeling. Kredit:© NUST MISIS Forskere fra National University of Science and Tech
Uventet nyt materiale er slukket til omgivelsestrykAlena Ponomareva og Igor Abrikosov, forfattere fra NUST MISIS diskuterer de grafiske resultater af den teoretiske modeling. Kredit:© NUST MISIS Forskere fra National University of Science and Tech -
 Dehydrerer planteproteiner med lydens hastighedEfter 8 minutter, den tørrede gel danner flager, der er lette og ikke-klæbende. Foto af Fred Zwicky Næsten alle kender til ultralyd – de højfrekvente lydbølger, der hopper rundt i kroppen og skabe
Dehydrerer planteproteiner med lydens hastighedEfter 8 minutter, den tørrede gel danner flager, der er lette og ikke-klæbende. Foto af Fred Zwicky Næsten alle kender til ultralyd – de højfrekvente lydbølger, der hopper rundt i kroppen og skabe
- Hvilke klasser skal du tage i gymnasiet, hvis du vil være kemisk ingeniør?
- Krager viser avancerede indlæringsevner
- Hvilke former mellem den opdelte kerne under cytokenese i planteceller?
- Hvilke grundstoffer har den laveste elektronegativitet cessium helium calciumfluor?
- Kan hormoner udskilles som respons på eksterne stimuli?
- Hvilket kemikalie bruges undertiden til at skabe cellulær plast?


