Hvilken familie af elementer er meget reaktiv på vand?
Disse inkluderer:
* Lithium (Li)
* Natrium (NA)
* Kalium (k)
* Rubidium (RB)
* Cesium (CS)
* Francium (FR)
Hvorfor er de så reaktive?
Alkalimetaller har kun et elektron i deres yderste skal. Dette gør dem ivrige efter at miste det elektron for at opnå en stabil elektronkonfiguration. Når de reagerer med vand, donerer de dette elektron til et hydrogenatom i vandmolekylet, danner en hydroxidion (OH-) og frigiver brintgas. Denne reaktion frigiver en masse energi, hvilket ofte får alkalimetallet til at antænde og eksplodere.
Her er en generel reaktion:
2m + 2h₂o → 2moh + H₂
Hvor:
* M repræsenterer alkalimetallet
* MOH repræsenterer det tilsvarende alkalimetalhydroxid
FORSIGTIG: Alkalimetaller er ekstremt farlige at håndtere. Brug altid ekstrem forsigtighed og korrekt sikkerhedsudstyr, når du arbejder med disse elementer.
 Varme artikler
Varme artikler
-
 Lys kan bruges til at kontrollere genfunktionenOptogenetics anvender metoder, hvor lys kan bruges til at styre cellulære funktioner. Kredit:Jari Rossi Lys kan bruges som en nøjagtig metode til at kontrollere genekspression, viser banebrydende
Lys kan bruges til at kontrollere genfunktionenOptogenetics anvender metoder, hvor lys kan bruges til at styre cellulære funktioner. Kredit:Jari Rossi Lys kan bruges som en nøjagtig metode til at kontrollere genekspression, viser banebrydende -
 Molekylær motorer:Kemisk karrusel roterer i kuldeKredit:CC0 Public Domain Molekylære motorer, som roterer ensrettet som svar på en ekstern energitilførsel, udgør en vigtig klasse af komponenter til fremtidige anvendelser inden for nanoteknologi.
Molekylær motorer:Kemisk karrusel roterer i kuldeKredit:CC0 Public Domain Molekylære motorer, som roterer ensrettet som svar på en ekstern energitilførsel, udgør en vigtig klasse af komponenter til fremtidige anvendelser inden for nanoteknologi. -
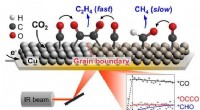 Kuldioxid omdannet til ethylen - industriens risRealtidsanalyse af katalytisk overflade i processen med elektrokemisk kuldioxidkonvertering af ethylen. Kredit:Korea Institute of Science and Technology (KIST) I den seneste tid, elektrokemisk kon
Kuldioxid omdannet til ethylen - industriens risRealtidsanalyse af katalytisk overflade i processen med elektrokemisk kuldioxidkonvertering af ethylen. Kredit:Korea Institute of Science and Technology (KIST) I den seneste tid, elektrokemisk kon -
 Selvkomprimerende beton bliver mere bæredygtig takket være at bruge granitresterEn UCO-undersøgelse beviser muligheden for at erstatte op til 40% af konventionelle tilslag af selvkomprimerende mørtel med granitslam, dermed reducere byggesektorens miljøbelastning. Kredit:Universit
Selvkomprimerende beton bliver mere bæredygtig takket være at bruge granitresterEn UCO-undersøgelse beviser muligheden for at erstatte op til 40% af konventionelle tilslag af selvkomprimerende mørtel med granitslam, dermed reducere byggesektorens miljøbelastning. Kredit:Universit
- Vedvarende ulige eksponering for luftforurening i Salt Lake County skoler
- Når en forstyrrelse opstår i hvilke retninger bevæger bølgerne sig?
- Ingeniører 3D-print med formskiftende smart gel
- Hvor meget gram i en viss?
- Billig metode til at adskille uopløsede materialer i en væske?
- Math regler for subtraktion


