Hvordan relaterer loven om bevaringsmasse til at afbalancere en kemisk ligning indeholdende koefficienter?
1. Repræsenterer atomer:
* Kemiske ligninger repræsenterer omarrangement af atomer under en kemisk reaktion.
* Hver kemisk formel i ligningen repræsenterer et specifikt molekyle eller forbindelse, hvilket indikerer de typer og antallet af tilstedeværende atomer.
2. Afbalancering til bevaring:
* Ubalanceret ligning: En ubalanceret ligning overholder ikke loven om bevarelse af masse. Det viser forskellige antal atomer af et bestemt element på reaktanternes side (til venstre) og produkternes side (højre) af ligningen.
* afbalancering: Koefficienter er hele tal placeret foran hver kemisk formel i ligningen. Disse koefficienter justeres for at sikre, at det samme antal af hver type atom vises på begge sider af ligningen.
3. Eksempel:
Lad os overveje reaktionen af brintgas (H₂) med iltgas (O₂) til at producere vand (H₂O):
* ubalanceret: H₂ + O₂ → H₂O
* Analyse:
* Reaktanter:2 hydrogenatomer, 2 iltatomer
* Produkter:2 hydrogenatomer, 1 iltatom
* afbalancering:
* 2H₂ + O₂ → 2H₂O
* Analyse:
* Reaktanter:4 hydrogenatomer, 2 iltatomer
* Produkter:4 hydrogenatomer, 2 iltatomer
4. Betydning:
Ved at afbalancere ligningen ved hjælp af koefficienter, sikrer vi, at:
* Det samme antal atomer i hvert element er til stede på begge sider af ligningen.
* Den samlede masse af reaktanterne svarer til den samlede masse af produkterne.
* Loven om bevarelse af masse opretholdes.
Afslutningsvis er afbalancering af kemiske ligninger med koefficienter afgørende for at sikre bevarelse af masse under kemiske reaktioner. Det sikrer, at antallet af atomer i hvert element forbliver konsistent under hele reaktionen, hvilket afspejler det grundlæggende princip, der ikke kan oprettes eller ødelægges.
Sidste artikelHvor mange gram er der i 0,07 mol CA?
Næste artikelHvad er almindeligt mellem 1 mol AG og AU?
 Varme artikler
Varme artikler
-
 Jagter lithium-ioner på farten i et hurtigt opladet batteriEt skematisk billede af den elektrokemiske minicelle, som forskerne byggede for at jage lithiumioner (orange), der bevæger sig i gitteret af LTO (blå). Kredit:Brookhaven National Laboratory Et tea
Jagter lithium-ioner på farten i et hurtigt opladet batteriEt skematisk billede af den elektrokemiske minicelle, som forskerne byggede for at jage lithiumioner (orange), der bevæger sig i gitteret af LTO (blå). Kredit:Brookhaven National Laboratory Et tea -
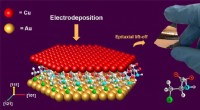 Forskere bruger aminosyrer til at dyrke højtydende kobber tynde filmKobbertynde film fremstilles ved elektroaflejring af kobber, Cu (111), på et selvsamlet organisk monolag af aminosyren L-cystein på guld, Au (111). Kredit:Bin Luo For første gang, forskere fra Mis
Forskere bruger aminosyrer til at dyrke højtydende kobber tynde filmKobbertynde film fremstilles ved elektroaflejring af kobber, Cu (111), på et selvsamlet organisk monolag af aminosyren L-cystein på guld, Au (111). Kredit:Bin Luo For første gang, forskere fra Mis -
 High-throughput computermodel forudsiger diffusionsdata for transporten af lette elementer i faste…Kredit:CC0 Public Domain Spredningen af lette elementer til metaller er blevet effektivt modelleret af A*STAR-forskere ved hjælp af en maskinlæringstilgang. Faststofdiffusion, hvor atomer migre
High-throughput computermodel forudsiger diffusionsdata for transporten af lette elementer i faste…Kredit:CC0 Public Domain Spredningen af lette elementer til metaller er blevet effektivt modelleret af A*STAR-forskere ved hjælp af en maskinlæringstilgang. Faststofdiffusion, hvor atomer migre -
 Open source-software behandler hurtigt spektrale data, identificerer og kvantificerer lipidarter nø…LIQUID-grænsefladen. Kredit:Pacific Northwest National Laboratory Lipider spiller en nøglerolle i mange stofskiftesygdomme, herunder hypertension, diabetes, og slagtilfælde. Så det er vigtigt at h
Open source-software behandler hurtigt spektrale data, identificerer og kvantificerer lipidarter nø…LIQUID-grænsefladen. Kredit:Pacific Northwest National Laboratory Lipider spiller en nøglerolle i mange stofskiftesygdomme, herunder hypertension, diabetes, og slagtilfælde. Så det er vigtigt at h
- Hvad er årsagerne til vibrationer i et induceret trækkøletårn?
- Hvad kan du forvente, når du forventer elektrisk transport
- Er super-Jorden faktisk mini-Neptunes?
- Netflix vil ikke sige, hvor mange der ser deres serier
- NASAs Kepler -teleskop er næsten løbet tør for brændstof, tvunget til at sove
- Hvorfor er en ring lavet af platin tættere end den samme størrelse sølv?


