Hvad er en brintisotop?
* Protoner: Alle hydrogenatomer har en proton. Det er dette, der definerer dem som brint.
* neutroner: Antallet af neutroner er det, der adskiller isotoperne.
Her er de tre vigtigste isotoper af brint:
1. Protium (¹H): Dette er den mest almindelige isotop, der består af en proton og ingen neutroner. Det er det, vi typisk tænker på som "brint."
2. deuterium (²h): Også kendt som "tungt brint" har det en proton og en neutron. Det er omtrent dobbelt så tungt som protium.
3. tritium (³h): Denne isotop har en proton og to neutroner. Det er radioaktivt og nedbrydes over tid.
Nøglepunkter:
* isotoper har de samme kemiske egenskaber: Fordi de har det samme antal protoner og elektroner, opfører isotoper af et element sig meget på samme måde i kemiske reaktioner.
* isotoper har forskellige fysiske egenskaber: Deres forskellige masser kan føre til lidt forskellige fysiske egenskaber som densitet, kogepunkt og diffusionshastighed.
* anvendelser: Isotoper af brint har forskellige anvendelser, herunder:
* deuterium: Brugt i atomreaktorer, som en sporstof i videnskabelig forskning og i nogle medicinske billeddannelsesteknikker.
* tritium: Brugt i nuklear fusionsforskning og i lysende maling.
Fortæl mig, hvis du har andre spørgsmål!
 Varme artikler
Varme artikler
-
 Kemikere bruger supercomputere til at forstå opløsningsmidlerUC-studerende Andrew Eisenhart brugte kvantesimuleringer til at forstå et almindeligt opløsningsmiddel, der lover grøn energi. Kredit:Colleen Kelley/UC Creative For at forstå de grundlæggende egen
Kemikere bruger supercomputere til at forstå opløsningsmidlerUC-studerende Andrew Eisenhart brugte kvantesimuleringer til at forstå et almindeligt opløsningsmiddel, der lover grøn energi. Kredit:Colleen Kelley/UC Creative For at forstå de grundlæggende egen -
 Biominering af fremtidens elementerKredit:Joey Kyber/Pixels, CC BY-SA Biomining er den slags teknik, der loves af science fiction:en stor tank fyldt med mikroorganismer, der udvasker metal fra malm, gamle mobiltelefoner og harddisk
Biominering af fremtidens elementerKredit:Joey Kyber/Pixels, CC BY-SA Biomining er den slags teknik, der loves af science fiction:en stor tank fyldt med mikroorganismer, der udvasker metal fra malm, gamle mobiltelefoner og harddisk -
 Ny algoritme kan hurtigere forudsige LED-materialerForskere fra University of Houston har udtænkt en ny maskinlæringsalgoritme, der er effektiv nok til at køre på en personlig computer og forudsige egenskaberne af mere end 100, 000 forbindelser på jag
Ny algoritme kan hurtigere forudsige LED-materialerForskere fra University of Houston har udtænkt en ny maskinlæringsalgoritme, der er effektiv nok til at køre på en personlig computer og forudsige egenskaberne af mere end 100, 000 forbindelser på jag -
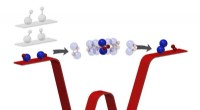 Med ultrakold kemi, forskere får et første kig på præcis, hvad der sker under en kemisk reaktionKemiske reaktioner omdanner reaktanter til produkter gennem en mellemliggende tilstand, hvor bindinger brydes og dannes. Ofte for kortvarig til at observere, denne fase har hidtil undgået intim unders
Med ultrakold kemi, forskere får et første kig på præcis, hvad der sker under en kemisk reaktionKemiske reaktioner omdanner reaktanter til produkter gennem en mellemliggende tilstand, hvor bindinger brydes og dannes. Ofte for kortvarig til at observere, denne fase har hidtil undgået intim unders
- Bæredygtighedslån giver muligheder for kemiske virksomheder
- Menneskelig evolution:tilbage til træerne?
- Hvordan virker klor til at rense svømmebassiner?
- Hvor mange atomer er der i 64 gram svovl?
- Hvor mange gram vanddamp skal der til for at mætte et kilogram luft ved temperatur -20 grader Celsi…
- Hvordan vil træsygdomme reagere på klimaændringer?


