Hvad sker der med et atom, hvis der er overskydende eller en mangel på elektroner?
Overskydende elektroner (anioner)
* Dannelse af ioner: Når et atom får ekstra elektroner, bliver det negativt ladet og kaldes en anion .
* Elektronkonfiguration: De ekstra elektroner fyldte tilgængelige orbitaler inden for atomets elektronskaller, der potentielt når en mere stabil elektronkonfiguration.
* Elektrostatisk attraktion: Den negative ladning af anionen tiltrækker positivt ladede ioner eller andre positivt ladede arter.
* Kemisk binding: Anioner deltager ofte i ioniske bindinger med kationer (positivt ladede ioner) og danner forbindelser som salte.
* Eksempler: Et chloratom (CL) får et elektron til at blive en chloridion (Cl-), en almindelig anion.
mangel på elektroner (kationer)
* Dannelse af ioner: Når et atom mister elektroner, bliver det positivt ladet og kaldes en kation .
* Elektronkonfiguration: Tabet af elektroner fjerner elektroner fra de yderste elektronskaller, som undertiden fører til en mere stabil konfiguration.
* Elektrostatisk attraktion: Kationens positive ladning tiltrækker negativt ladede ioner eller andre negativt ladede arter.
* Kemisk binding: Kationer deltager ofte i ioniske bindinger med anioner og danner forbindelser som salte.
* Eksempler: Et natriumatom (NA) mister et elektron for at blive en natriumion (Na+), en almindelig kation.
Nøglepunkter:
* neutrale atomer: I deres neutrale tilstand har atomer et lige antal protoner (positiv ladning) og elektroner (negativ ladning).
* stabilitet: Atomer har en tendens til at vinde eller miste elektroner for at opnå en stabil elektronkonfiguration som en ædel gas.
* ioner: Ioner er atomer, der har opnået eller mistet elektroner og bærer en netto elektrisk ladning.
Kortfattet: Atomer, der får eller mister elektroner, bliver ioner, som er afgørende for at danne ioniske forbindelser og deltage i mange kemiske reaktioner.
Sidste artikelHvad er en brintisotop?
Næste artikelHvilke materialer er ikke et eksempel på en god dirigent?
 Varme artikler
Varme artikler
-
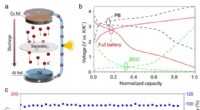 Konstruktion af kulstofbaserede celle-lignende kugler til robust kaliumanode(a) Skematisk illustration af K-ion-fuldbatteriet baseret på det forberedte BCC og Preussisk blå (PB). (b) Opladningsafladningsprofiler for halvbatteriet og fuldt batteri. (c) Cykelstabilitet ved 500
Konstruktion af kulstofbaserede celle-lignende kugler til robust kaliumanode(a) Skematisk illustration af K-ion-fuldbatteriet baseret på det forberedte BCC og Preussisk blå (PB). (b) Opladningsafladningsprofiler for halvbatteriet og fuldt batteri. (c) Cykelstabilitet ved 500 -
 Små molekyler, kæmpe (overflade) potentialeNye molekyler skabt af forskere ved Kyushu University flugter i gennemsnit med den samme del af molekylet, der peger væk fra en overflade. Ved at fastgøre forskellige enheder, der skubber eller trække
Små molekyler, kæmpe (overflade) potentialeNye molekyler skabt af forskere ved Kyushu University flugter i gennemsnit med den samme del af molekylet, der peger væk fra en overflade. Ved at fastgøre forskellige enheder, der skubber eller trække -
 Forskning i retning af levedygtige, sikre batterier overvinder høj modstand, solid-state barrierer …Kredit:A. James Clark School of Engineering, University of Maryland Ingeniører ved University of Maryland har udviklet et middel til at overvinde forhindringer i udviklingen af solid-state batte
Forskning i retning af levedygtige, sikre batterier overvinder høj modstand, solid-state barrierer …Kredit:A. James Clark School of Engineering, University of Maryland Ingeniører ved University of Maryland har udviklet et middel til at overvinde forhindringer i udviklingen af solid-state batte -
 Madforskere opdager usolgt brød til velsmagende probiotisk drink og skærer madspild nedNUS fødevareforskere Assoc Prof Liu Shao Quan (venstre), Frøken Nguyen Thuy Linh (i midten) og dr. Toh Mingzhan (til højre) kom med en patenteret nul-affaldsproces for at lave en ny probiotisk drik ve
Madforskere opdager usolgt brød til velsmagende probiotisk drink og skærer madspild nedNUS fødevareforskere Assoc Prof Liu Shao Quan (venstre), Frøken Nguyen Thuy Linh (i midten) og dr. Toh Mingzhan (til højre) kom med en patenteret nul-affaldsproces for at lave en ny probiotisk drik ve
- Hvis du kaster en gekko på Teflon, vil han så holde sig? Forskere fra University of Akron fandt sv…
- Forskere afslører sammenhængen mellem jobtitler og ligestilling
- Kan defekter gøre inaktive materialer til nyttige, aktive?
- Overfører alle bølger inklusive mekanisk energi?
- Udenomjordisk Hypatia-sten rasler solsystemets status quo
- En hastighedsgrænse gælder også i kvanteverdenen


