Hvorfor hverken væsker eller gasser har faste former?
væsker:
* svage intermolekylære kræfter: Molekylerne i væsker holdes sammen af svagere kræfter sammenlignet med faste stoffer. Disse kræfter er stærke nok til at holde molekylerne tæt sammen, men ikke stærke nok til at holde dem i et fast arrangement.
* Fluid Natur: Væsker betragtes som væsker, fordi deres molekyler let kan glide forbi hinanden. Dette giver dem mulighed for at flyde og tage formen på deres beholder.
Gasser:
* meget svage intermolekylære kræfter: Molekylerne i gasser har ekstremt svage intermolekylære kræfter. De bevæger sig frit og uafhængigt med meget lidt tiltrækning til hinanden.
* høj kinetisk energi: Gasmolekyler har høj kinetisk energi, hvilket betyder, at de konstant bevæger sig og kolliderer med hinanden. Denne konstante bevægelse forhindrer dem i at danne en fast form.
Kortfattet:
Manglen på en fast form i væsker og gasser skyldes kombinationen af svagere intermolekylære kræfter og deres molekylers evne til at bevæge sig frit i forhold til hinanden. Dette giver dem mulighed for at påtage sig formen på deres beholder.
 Varme artikler
Varme artikler
-
 Ny sammensat katalysator holder løfte om omkostningseffektiv omdannelse af ethanol til jet-brændst…Luftfart bidrager med omkring 2,5% af de globale kuldioxidemissioner. For i høj grad at reducere sine emissioner, den amerikanske kommercielle luftfartssektor har brug for nye metoder til fremstilling
Ny sammensat katalysator holder løfte om omkostningseffektiv omdannelse af ethanol til jet-brændst…Luftfart bidrager med omkring 2,5% af de globale kuldioxidemissioner. For i høj grad at reducere sine emissioner, den amerikanske kommercielle luftfartssektor har brug for nye metoder til fremstilling -
 Nye biomaterialer kan finjusteres til medicinske anvendelserKredit:Unsplash/CC0 Public Domain Det er lykkedes forskere i Storbritannien og USA at finjustere et nyt termoplastisk biomateriale, så både den hastighed, hvormed det nedbrydes i kroppen, og dets
Nye biomaterialer kan finjusteres til medicinske anvendelserKredit:Unsplash/CC0 Public Domain Det er lykkedes forskere i Storbritannien og USA at finjustere et nyt termoplastisk biomateriale, så både den hastighed, hvormed det nedbrydes i kroppen, og dets -
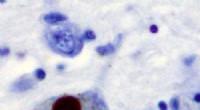 Forskere udvikler nye kemiske biologiske værktøjer til at overvåge Parkinsons sygdomImmunhistokemi for alfa-synuclein, der viser positiv farvning (brun) af et intraneuralt Lewy-legeme i Substantia nigra ved Parkinsons sygdom. Kredit:Wikipedia Forskere er et skridt tættere på at fo
Forskere udvikler nye kemiske biologiske værktøjer til at overvåge Parkinsons sygdomImmunhistokemi for alfa-synuclein, der viser positiv farvning (brun) af et intraneuralt Lewy-legeme i Substantia nigra ved Parkinsons sygdom. Kredit:Wikipedia Forskere er et skridt tættere på at fo -
 Bæredygtigt strukturelt materiale til plasterstatningDet cellulose nanofiber-afledte bulk CNFP-strukturmateriale og dets karakterisering. (a) Fotografi af CNFP i stor størrelse med et volumen på 320 × 220 × 27 mm3. (b) CNFPs robuste 3D nanofibernetværk.
Bæredygtigt strukturelt materiale til plasterstatningDet cellulose nanofiber-afledte bulk CNFP-strukturmateriale og dets karakterisering. (a) Fotografi af CNFP i stor størrelse med et volumen på 320 × 220 × 27 mm3. (b) CNFPs robuste 3D nanofibernetværk.
- Teamet opdager protein, lipidforbindelse, der kan hjælpe nye influenzabehandlinger
- Dræber Stillehavets kemi livet i havet?
- Hvad er en definition af base?
- Hvad går der ind i Norges dommedagshvelv?
- Yderligere to polymorfer fundet for rød-orange-gul
- COVID -lockdown forårsager rekordfald i CO2 -emissioner i 2020


