Har ilt en krystal som nitrogen?
Her er hvorfor:
* nitrogen (N2): Nitrogen danner et diatomisk molekyle (N2) og findes som en gas ved stuetemperatur. Under højt tryk og lav temperatur kan det størkne og danne en krystalstruktur. Den mest almindelige form er alfa-nitrogen , som har en kubisk tætpakket struktur.
* ilt (O2): Oxygen findes også som et diatomisk molekyle (O2) og er en gas ved stuetemperatur. Imidlertid kan ilt ikke danne en krystalstruktur som nitrogen under normale forhold. I stedet størkner det til en triclinic struktur , som er mindre symmetrisk og tættere end nitrogens kubiske struktur.
Årsagen til denne forskel ligger i de intermolekylære kræfter mellem molekylerne. Nitrogen har svagere van der Waals -styrker sammenlignet med ilt. Disse kræfter er stærke nok til at holde nitrogenmolekyler sammen i en krystallinsk struktur under de rigtige betingelser, men ikke stærke nok til ilt.
For at opsummere, mens både nitrogen og ilt er diatomiske gasser, fører deres molekylære strukturer og intermolekylære kræfter til forskellige opførsler i deres faste tilstande. Oxygen's faste form udviser ikke den samme krystalstruktur som nitrogen.
Sidste artikelHvad er krystalstruktur af Cao2?
Næste artikelDosis malachit Har du en krystalstruktur?
 Varme artikler
Varme artikler
-
 Nye antibakterielle lægemidler udviklet ved University of Eastern FinlandDen nye LsrK -hæmmer udviklet af forskerne (strukturbilledet til venstre) binder sig til det aktive område af målproteinet (atombillede i bunden). Ved at hæmme funktionen af LsrK, det er muligt at b
Nye antibakterielle lægemidler udviklet ved University of Eastern FinlandDen nye LsrK -hæmmer udviklet af forskerne (strukturbilledet til venstre) binder sig til det aktive område af målproteinet (atombillede i bunden). Ved at hæmme funktionen af LsrK, det er muligt at b -
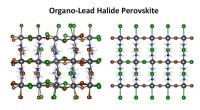 Forskere udvikler innovative teknikker til højopløsningsanalyse af hybridmaterialerSkematisk af organo-blyhalogenidperovskit, der viser forvrængninger fra tilfældige halogenidpositioner (venstre) versus ordnede halogenidpositioner (højre). Et Berkeley Lab-studie viser, at der findes
Forskere udvikler innovative teknikker til højopløsningsanalyse af hybridmaterialerSkematisk af organo-blyhalogenidperovskit, der viser forvrængninger fra tilfældige halogenidpositioner (venstre) versus ordnede halogenidpositioner (højre). Et Berkeley Lab-studie viser, at der findes -
 Opfindelse udløst af COVID-19-pandemi desinficerer overflader sikkert kontinuerligtKredit:Pixabay/CC0 Public Domain En opfindelse til at påføre plasma på genstande, der ofte berøres, til kontinuerlig desinfektion kunne give en sikker og effektiv, ikke-kemisk måde at reducere pat
Opfindelse udløst af COVID-19-pandemi desinficerer overflader sikkert kontinuerligtKredit:Pixabay/CC0 Public Domain En opfindelse til at påføre plasma på genstande, der ofte berøres, til kontinuerlig desinfektion kunne give en sikker og effektiv, ikke-kemisk måde at reducere pat -
 Adskillelse af gasser ved hjælp af fleksible molekylsigterMolekylærsigternes dynamiske natur og fleksibilitet er afgørende for at forstå deres ydeevne til transport af små molekyler. Kredit:University of Liverpool Forskere ved University of Liverpool og
Adskillelse af gasser ved hjælp af fleksible molekylsigterMolekylærsigternes dynamiske natur og fleksibilitet er afgørende for at forstå deres ydeevne til transport af små molekyler. Kredit:University of Liverpool Forskere ved University of Liverpool og
- Antarktishav er vært for en overraskende blanding af livsformer - og nu kan vi kortlægge dem
- Albinisme i Tanzania:Hvad kan man gøre for at bryde stigmatiseringen
- Hvorfor har et bjerg mere energi end spabad?
- Forskere beskriver hidtil ukendt mekanisme til at inducere elektronemission i højt orienteret pyrol…
- Frigivelse af solpaneldatasæt hjælper byer med at gøre elnettene mere sikre, pålidelig
- Kræver den lettede diffusion ikke celle for at bruge energi?


