Hvad er krystalstruktur af Cao2?
Her er hvorfor:
* ustabilitet: Calciumperoxid er en meget reaktiv forbindelse, der let nedbrydes til calciumoxid (CAO) og iltgas (O2). Denne nedbrydning forekommer selv ved stuetemperatur.
* Nedbrydningsprodukter: Nedbrydningen af CaO2 er favoriseret termodynamisk, hvilket betyder, at den frigiver energi og er mere stabil i sin dekomponerede form.
* Begrænsede undersøgelser: På grund af dens ustabilitet er der begrænsede undersøgelser af krystalstrukturen af CaO2.
Imidlertid antyder nogle teoretiske beregninger, at CaO2 potentielt kunne eksistere i en krystalstruktur, der ligner antifluoritstrukturen. Denne struktur er kendetegnet ved et ansigt-centreret kubikgitter, hvor calciumionerne (Ca2+) besætter hjørnerne og ansigtscentre, og peroxidionerne (O22-) besætter de tetrahedrale interstitielle steder.
Vigtig note: Det er meget usandsynligt at finde CaO2 i en stabil krystallinsk form under normale forhold. Det er primært kendt som et kortvarigt mellemprodukt i forskellige kemiske reaktioner.
Sidste artikelHvad er en rå blanding, jeg ved, hvilken olie, men den samme ting?
Næste artikelHar ilt en krystal som nitrogen?
 Varme artikler
Varme artikler
-
 Atomskala simulering af antiarytmisk lægemiddelinteraktion med hjertecellerAt afsløre de mystiske mekanismer for lægemiddelstyrke til behandling af hjertearytmier, UC Davis Health-forskere har udviklet nye simuleringer, der giver indsigt i vitale atom-skala lægemiddel-hjerte
Atomskala simulering af antiarytmisk lægemiddelinteraktion med hjertecellerAt afsløre de mystiske mekanismer for lægemiddelstyrke til behandling af hjertearytmier, UC Davis Health-forskere har udviklet nye simuleringer, der giver indsigt i vitale atom-skala lægemiddel-hjerte -
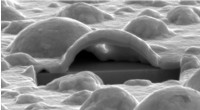 Platin danner nano-boblerElektronmikroskopudsigt ind i det indre af en platinboble. Tværsnittet blev eksponeret med en fokuseret ionstråle. Under den hule Pt-boble kan den kantede YSZ-krystal ses. Kredit:DESY, Satishkumar Kul
Platin danner nano-boblerElektronmikroskopudsigt ind i det indre af en platinboble. Tværsnittet blev eksponeret med en fokuseret ionstråle. Under den hule Pt-boble kan den kantede YSZ-krystal ses. Kredit:DESY, Satishkumar Kul -
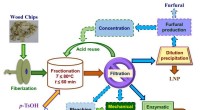 Delignificering af træprøver ved hjælp af p-toluensulfonsyre som en genanvendelig hydrotropSkematisk flowdiagram viser træfraktionering ved hjælp af p-TsOH til produktion af fibre, lignocellulosiske nanomaterialer, sukker, og LNPer. Processer med stiplede linjer blev ikke udført i denne und
Delignificering af træprøver ved hjælp af p-toluensulfonsyre som en genanvendelig hydrotropSkematisk flowdiagram viser træfraktionering ved hjælp af p-TsOH til produktion af fibre, lignocellulosiske nanomaterialer, sukker, og LNPer. Processer med stiplede linjer blev ikke udført i denne und -
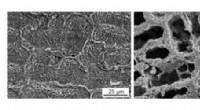 Forskere styrker det svageste led i fremstilling af stærke materialerOverfladeudseende af det udviklede stål indeholdende kobber (venstre) og kobberfrit modstykke (højre). Kredit:Kenta Yamanaka et al, Tohoku Universitet Industriel og bilmaskiner, såsom bildele i mo
Forskere styrker det svageste led i fremstilling af stærke materialerOverfladeudseende af det udviklede stål indeholdende kobber (venstre) og kobberfrit modstykke (højre). Kredit:Kenta Yamanaka et al, Tohoku Universitet Industriel og bilmaskiner, såsom bildele i mo


