Hvilken type ioner dannes ikke -metaller?
Her er hvorfor:
* Elektronkonfiguration: Ikke -metaller har en tendens til at have næsten fulde ydre elektronskaller. For at opnå en stabil elektronkonfiguration som ædle gasser får de elektroner.
* Elektronegativitet: Ikke -metaller har højere elektronegativitet end metaller. Dette betyder, at de har en stærkere attraktion for elektroner.
Når en ikke -metal får elektroner, bliver den negativt ladet, fordi den nu har flere elektroner end protoner. Denne negative ladning er det, der gør det til en anion.
Eksempler på ikke -metalanioner:
* Chloridion (cl⁻)
* Oxidion (o²⁻)
* Nitridion (n³⁻)
* Sulfidion (s²⁻)
* Fluoridion (f⁻)
Sidste artikelHvordan findes atomvægten af et element?
Næste artikelEr en anion mindre end atomet, hvorfra det producerede?
 Varme artikler
Varme artikler
-
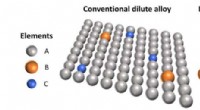 Fremme af multiprincipale legeringer:Forskere udforsker nye domæner af sammensætningsmæssigt komp…Sløring af grænserne mellem majoritets- og minoritetspopulationer af atomarter i en multiprincipal elementlegering (til højre) fører til et robust atomlandskab, åbne nye veje for defekter at navigere.
Fremme af multiprincipale legeringer:Forskere udforsker nye domæner af sammensætningsmæssigt komp…Sløring af grænserne mellem majoritets- og minoritetspopulationer af atomarter i en multiprincipal elementlegering (til højre) fører til et robust atomlandskab, åbne nye veje for defekter at navigere. -
 Molekylær energimaskine som filmstjerneTobias Weinert, biokemiker hos PSI, med den eksperimentelle opsætning til excitation query krystallografien ved SLS:En injektor producerer en 50 mikrometer (som et hår) tynd strøm af en tandpasta-lign
Molekylær energimaskine som filmstjerneTobias Weinert, biokemiker hos PSI, med den eksperimentelle opsætning til excitation query krystallografien ved SLS:En injektor producerer en 50 mikrometer (som et hår) tynd strøm af en tandpasta-lign -
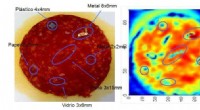 Design af sensorer til at detektere fremmedlegemer i fødevarerBillede opnået med denne teknologi, hvor der kan ses, på et stykke pølse, plast, metaller og splinter af glas i forskellige størrelser og former. Kredit:Elhuyar Fundazioa Forskere ved NUP/UPNA-Pub
Design af sensorer til at detektere fremmedlegemer i fødevarerBillede opnået med denne teknologi, hvor der kan ses, på et stykke pølse, plast, metaller og splinter af glas i forskellige størrelser og former. Kredit:Elhuyar Fundazioa Forskere ved NUP/UPNA-Pub -
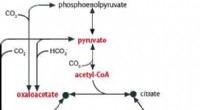 Opdagelse af et oprindeligt metabolisk system, der giver os et glimt af livets oprindelse på JordenFig. 1:Forholdet mellem TCA -cyklussen og pyruvat, acetyl-CoA, oxaloacetat, oxoglutarat, og succinyl-CoA er vist. Kredit:Hokkaido University Multi-omics forskning på Thermosulfidibacter (isoleret
Opdagelse af et oprindeligt metabolisk system, der giver os et glimt af livets oprindelse på JordenFig. 1:Forholdet mellem TCA -cyklussen og pyruvat, acetyl-CoA, oxaloacetat, oxoglutarat, og succinyl-CoA er vist. Kredit:Hokkaido University Multi-omics forskning på Thermosulfidibacter (isoleret
- Hvad er den balancerede ligning for reaktion mellem salpetersyre og natriumhydroxid?
- Hvilket udtryk defineres som et molekyle dannet af to monosaccharider?
- Kunne mere af Jordens overflade være vært for liv? Jupiters kredsløbsform spiller en vigtig, over…
- Forskere undersøger potentiel trussel mod talebeskyttelse via smartphones bevægelsessensorer
- Hvordan man opbygger Spaghetti & Marshmallow Tower
- Sådan laver du en 3D-pyramide med papir


