Hvordan findes atomvægten af et element?
1. Identificering af isotoper:
* massespektrometri: Denne teknik adskiller atomer baseret på deres forhold mellem masse og ladning. Det giver forskere mulighed for at identificere de forskellige isotoper i et element og deres relative overflod.
* nukleær magnetisk resonans (NMR): NMR -spektroskopi kan også bruges til at bestemme tilstedeværelsen og forekomsten af isotoper, især for lettere elementer.
2. Bestemmelse af isotopiske forekomster:
* massespektrometri: Topphøjderne i et massespektrum er proportional med forekomsten af hver isotop.
* Andre teknikker: Andre metoder som neutronaktiveringsanalyse kan også anvendes til at bestemme isotopiske forekomster.
3. Beregning af det vægtede gennemsnit:
* masse af hver isotop x overflod af hver isotop: Dette gøres for alle isotoper af elementet.
* Sum Resultaterne: Dette giver elementets atomvægt.
Eksempel:
Lad os tage elementet klor (CL):
* isotop 1: CL-35 (masse =34.9689 AMU), overflod =75,77%
* isotop 2: CL-37 (masse =36.9659 amu), overflod =24,23%
atomvægt af klor:
(34.9689 Amu X 0.7577) + (36.9659 Amu X 0.2423) = 35.45 Amu
Vigtige punkter:
* Atomvægt er en relativ værdi, hvilket betyder, at den sammenlignes med massen af et carbon-12-atom.
* Atomvægten er ikke et heltal, fordi det er et gennemsnit af forskellige isotoper med fraktionerede forekomster.
* Atomvægten kan variere lidt afhængigt af kilden til elementet.
Denne proces hjælper forskere med at forstå sammensætningen af elementer og deres opførsel i kemiske reaktioner.
Sidste artikelHvad forhindrer udtørring eller tørring i Spirogyra?
Næste artikelHvilken type ioner dannes ikke -metaller?
 Varme artikler
Varme artikler
-
 Æg-baserede influenzavacciner:Ikke alle, de er oplagte til at være?Kredit:CC0 Public Domain Influenzasæsonen er i gang på den nordlige halvkugle, gør millioner af mennesker syge og i sjældne tilfælde, forårsage hospitalsindlæggelse eller død. Den bedste forebygge
Æg-baserede influenzavacciner:Ikke alle, de er oplagte til at være?Kredit:CC0 Public Domain Influenzasæsonen er i gang på den nordlige halvkugle, gør millioner af mennesker syge og i sjældne tilfælde, forårsage hospitalsindlæggelse eller død. Den bedste forebygge -
 Beregningsmæssig forskning beskriver aktiveringsmekanismen for p38-alfaForskere afslørede detaljer om p38 -aktiveringsmekanismen. Billedet repræsenterer de strukturelle ændringer fra den inaktive tilstand (lilla) til den aktive (grøn) foreslået af røntgenkrystallografi.
Beregningsmæssig forskning beskriver aktiveringsmekanismen for p38-alfaForskere afslørede detaljer om p38 -aktiveringsmekanismen. Billedet repræsenterer de strukturelle ændringer fra den inaktive tilstand (lilla) til den aktive (grøn) foreslået af røntgenkrystallografi. -
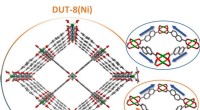 Ny indsigt i omskiftelige MOF-strukturerSe ind i en MOF-krystal eksemplificeret ved DUT-8. De massive porer kan tydeligt mærkes. Kredit:TU Dresden Metal-organiske rammeforbindelser (MOFer) består af uorganiske og organiske grupper og er
Ny indsigt i omskiftelige MOF-strukturerSe ind i en MOF-krystal eksemplificeret ved DUT-8. De massive porer kan tydeligt mærkes. Kredit:TU Dresden Metal-organiske rammeforbindelser (MOFer) består af uorganiske og organiske grupper og er -
 Anti-degranulering og galdesyrebindende aktivitet af frugter og agroindustrielle biprodukterKredit:Anna Langova/Public Domain De ubrugte dele af frugt og grøntsager, såsom frugtkød efter juicening, indeholder ofte flere fytokemikalier med bioregulerende funktioner end de brugte dele, men
Anti-degranulering og galdesyrebindende aktivitet af frugter og agroindustrielle biprodukterKredit:Anna Langova/Public Domain De ubrugte dele af frugt og grøntsager, såsom frugtkød efter juicening, indeholder ofte flere fytokemikalier med bioregulerende funktioner end de brugte dele, men
- Forskere kortlægger de største magnetiske felter i galaksehobe ved hjælp af synkrotronintensitets…
- Hvilken type sedimentær sten er dannet fra fragmenter af mineraler eller klipper?
- Kina til at oprette et system til beskyttelse af teknologisk sikkerhed
- Hvordan hjalp glaciale aflejringer med at understøtte teorien om pladetektonik?
- Er $ 1, 100 for meget for en iPhone? Få en ældre for mindre
- Aktivt kul kan føre til lugtfri bleer


