Hvordan kan to coumpounds lavet af det samme element være så anderledes?
1. Forskellig limning:
* ionisk vs. kovalent: Den måde, elementer binder sammen sammen, kan drastisk ændre en sammensat opførsel. Ioniske bindinger involverer overførsel af elektroner, hvilket skaber ladede ioner, der stærkt tiltrækker hinanden. Kovalente bindinger involverer deling af elektroner, der danner molekyler med forskellige niveauer af styrke.
* Eksempel: Natriumchlorid (NaCl) er en ionisk forbindelse, der skaber en krystalstruktur og opløst let i vand. Methan (CH4) er kovalent og danner en gas, der er dårligt opløselig i vand.
2. Molekylær struktur:
* Formspørgsmål: Arrangementet af atomer inden for et molekyle påvirker markant dens egenskaber. Selv de samme elementer kan danne forskellige former.
* Eksempel: Glukose og fruktose har begge formlen C6H12O6, men glukose er en ringform, og fruktose er en kæde, der fører til forskellig sødme og reaktivitet.
3. Funktionelle grupper:
* Tilføjelse af kompleksitet: Specifikke grupper af atomer, der er knyttet til et molekyle (funktionelle grupper), kan dramatisk ændre dens egenskaber.
* Eksempel: Ethanol (C2H5OH) har en hydroxylgruppe (-OH), hvilket gør den til en væske ved stuetemperatur og i stand til at opløses i vand. Ethan (C2H6) mangler denne gruppe, hvilket gør den til en gas ved stuetemperatur og dårligt opløselig i vand.
4. Intermolekylære kræfter:
* attraktive interaktioner: Kræfterne i tiltrækning mellem molekyler (intermolekylære kræfter) påvirker egenskaber som smeltepunkt, kogepunkt og viskositet.
* Eksempel: Vand (H2O) har stærk hydrogenbinding, hvilket giver det et højt kogepunkt. Metan (CH4) har kun svage van der Waals -kræfter, hvilket gør det til en gas ved stuetemperatur.
5. Allotropes:
* det samme element, forskellig form: Nogle elementer kan eksistere i forskellige strukturelle former kaldet allotropes.
* Eksempel: Diamond og grafit er begge lavet af rent kulstof, men deres atomarrangementer giver dem meget forskellige egenskaber. Diamond er utroligt hård, mens grafit er blød og glat.
Konklusion:
Kombinationen af binding, molekylær struktur, funktionelle grupper, intermolekylære kræfter og allotropy spiller alle en afgørende rolle i bestemmelsen af forbindelsens egenskaber, selvom de er fremstillet af de samme elementer.
Sidste artikelHvilke elektroner har kun en bane eller skal?
Næste artikelLækker legeringshjul luft i under nul temps?
 Varme artikler
Varme artikler
-
 Lab udvikler dual-overflade grafenelektrode til at splitte vand i hydrogen og iltEn tosidet elektrokatalysator udviklet ved Rice University deler vand i hydrogen på den ene side og ilt på den anden. Hydrogensiden, der ses i elektronmikroskopbilleder, har platinpartikler (de mørke
Lab udvikler dual-overflade grafenelektrode til at splitte vand i hydrogen og iltEn tosidet elektrokatalysator udviklet ved Rice University deler vand i hydrogen på den ene side og ilt på den anden. Hydrogensiden, der ses i elektronmikroskopbilleder, har platinpartikler (de mørke -
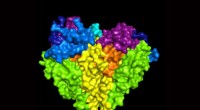 Team opdager molekylær kanal, der regulerer blodtrykketVed hjælp af et kryo-elektronmikroskop, forskere ved OHSU i Portland, Oregon, genereret en tredimensionel model af den humane epitheliale natriumkanal. Kanalen er kritisk til at kontrollere blodtrykke
Team opdager molekylær kanal, der regulerer blodtrykketVed hjælp af et kryo-elektronmikroskop, forskere ved OHSU i Portland, Oregon, genereret en tredimensionel model af den humane epitheliale natriumkanal. Kanalen er kritisk til at kontrollere blodtrykke -
 Video:Hvordan hårfarve virkerKredit:The American Chemical Society Uanset om du har brug for en forklædning for at løbe fra loven eller bare prøver at efterligne *NSYNC-tidens frostede tip, du kan få brug for noget kemisk assi
Video:Hvordan hårfarve virkerKredit:The American Chemical Society Uanset om du har brug for en forklædning for at løbe fra loven eller bare prøver at efterligne *NSYNC-tidens frostede tip, du kan få brug for noget kemisk assi -
 Enkel metode til keramisk-baserede fleksible elektrolytplader til lithiummetalbatterierI den nærmeste fremtid, lithiummetalbatterier med en fleksibel LLZO elektrolytplade kan bruges i avancerede elektriske køretøjer (EVer). Kredit:Tokyo Metropolitan University 1000°C) processer. Den
Enkel metode til keramisk-baserede fleksible elektrolytplader til lithiummetalbatterierI den nærmeste fremtid, lithiummetalbatterier med en fleksibel LLZO elektrolytplade kan bruges i avancerede elektriske køretøjer (EVer). Kredit:Tokyo Metropolitan University 1000°C) processer. Den
- De fleste af ATP -aerob respiration produceres direkte fra membranhydrogengradienter skabt af?
- En løgs cellestruktur
- Hvad er funktionen af ledende ledninger?
- En ToM-baseret algoritme til estimering af menneskelige hensigter til robotiserede lagre
- Hvordan hjalp den internationale rumstation udforskningen af rummet?
- Opdagelse af Mitochondria


