Hvad octetreglen er tilfreds, når to atomer erhverver, hvor mange valenselektroner?
Her er hvorfor:
* Valenselektroner: Dette er elektronerne i den yderste skal af et atom, der er involveret i kemisk binding.
* octet regel: Atomer har en tendens til at vinde, tabe eller dele elektroner for at opnå en stabil konfiguration med otte valenselektroner, der ligner den ædle gaskonfiguration. Denne stabilitet skyldes den fyldte yderste skal, hvilket gør dem mindre reaktive.
Eksempel:
Overvej dannelsen af et natriumchlorid (NaCl) molekyle:
* Natrium (NA) har en valenselektron.
* Chlor (CL) har syv valenselektroner.
Når natrium mister sin ene valenselektron, bliver det en positivt ladet ion (Na+). Klor vinder denne elektron og bliver en negativt ladet ion (Cl-). Begge ioner har nu otte valenselektroner, der tilfredsstiller oktetreglen. Den elektrostatiske tiltrækning mellem disse modsatte ladede ioner danner den ioniske binding i NaCI.
Husk, at octetreglen er en generalisering, og der er undtagelser, især for elementer i den anden periode (som brint og lithium).
Sidste artikelHvad er porøse faste stoffer?
Næste artikelHvilken effekt har salt på varmt vand?
 Varme artikler
Varme artikler
-
 En ny måde at skabe bløde robotter på - DNA-triggere, der får hydrogeler til at ændre formInde i laboratoriet med David Gracias, Vicky Nguyen, og Rebecca Schulman. Kredit:Will Kirk / Homewood Photography Biokemiske ingeniører ved Johns Hopkins University brugte sekvenser af DNA-molekyl
En ny måde at skabe bløde robotter på - DNA-triggere, der får hydrogeler til at ændre formInde i laboratoriet med David Gracias, Vicky Nguyen, og Rebecca Schulman. Kredit:Will Kirk / Homewood Photography Biokemiske ingeniører ved Johns Hopkins University brugte sekvenser af DNA-molekyl -
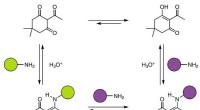 Kemikere fremstiller termohærdende polymer ved hjælp af amin og triketon, der kan genbrugesVendbar, dynamiske kovalente diketoenaminbindinger. Diketoenaminbindinger dannes spontant fra triketoner og både aromatiske og alifatiske aminer. Under stærkt sure forhold i vand, diketoenaminbindinge
Kemikere fremstiller termohærdende polymer ved hjælp af amin og triketon, der kan genbrugesVendbar, dynamiske kovalente diketoenaminbindinger. Diketoenaminbindinger dannes spontant fra triketoner og både aromatiske og alifatiske aminer. Under stærkt sure forhold i vand, diketoenaminbindinge -
 Gør som et blad:Forskere udvikler metode til at omdanne kuldioxidKredit:CC0 Public Domain Professor Jun Huang fra University of Sydneys School of Chemical and Biomolecular Engineering er ved at udvikle en kulstoffangstmetode, der sigter mod at gå et skridt ud o
Gør som et blad:Forskere udvikler metode til at omdanne kuldioxidKredit:CC0 Public Domain Professor Jun Huang fra University of Sydneys School of Chemical and Biomolecular Engineering er ved at udvikle en kulstoffangstmetode, der sigter mod at gå et skridt ud o -
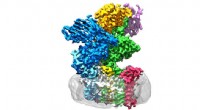 Hæft sukker til proteinEnzymet oligosaccharyltransferase er placeret i membranen (grå) og består af otte underenheder. Kredit:Julia Kowal / ETH Zürich ETH-forskere er lykkedes med at bestemme 3-D-strukturen af enzymet
Hæft sukker til proteinEnzymet oligosaccharyltransferase er placeret i membranen (grå) og består af otte underenheder. Kredit:Julia Kowal / ETH Zürich ETH-forskere er lykkedes med at bestemme 3-D-strukturen af enzymet


