Hæft sukker til protein
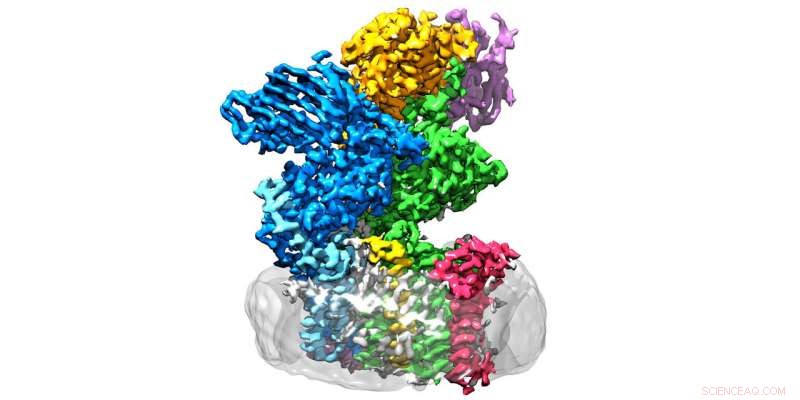
Enzymet oligosaccharyltransferase er placeret i membranen (grå) og består af otte underenheder. Kredit:Julia Kowal / ETH Zürich
ETH-forskere er lykkedes med at bestemme 3-D-strukturen af enzymet, der binder sukkerkæder til proteiner - et gennembrud, som de for nylig har offentliggjort i tidsskriftet Videnskab .
Når celler modtager signaler, interagere med andre celler eller identificere vira og bakterier, processen involverer ikke kun proteiner, men også sukkerkæder knyttet til deres overflade. Emnet, der indtil nu har været relativt lidt opmærksomhed, disse strukturer adskiller sig meget i sammensætning og forgrening, og synes at være med til at sikre, at proteiner foldes korrekt og er i stand til at udføre deres specifikke opgaver.
Flere observationer viser vigtigheden af de sukkerholdige vedhæng:identiske proteiner med forskellige sukkerkæder har forskellige funktioner, syge og raske celler har forskellige sukkersammensætninger på deres overflader, og lægemidler, som de er knyttet til, tolereres tilsyneladende bedre.
Hvordan kommer sukkeret videre til proteinet?
Kendt som glykaner, disse stoffer er i øjeblikket genstand for intensiv forskning. Efter genomik og proteomik, der er nu også glykomik. Det nye forskningsfelt glykobiologi beskæftiger sig med biosyntese, struktur og de sukkerholdige vedhængs forskellige funktioner. Et nøglespørgsmål er, hvordan det mangfoldige sæt af sukkermolekyler når frem til proteinerne i første omgang.

Kryoelektronmikroskopbilleder af enzymet. Kredit:Rebekka Wild / ETH Zürich
ETH-forskere i grupperne ledet af Kaspar Locher fra Institut for Molekylær Biologi og Biofysik og Markus Aebi fra Institut for Mikrobiologi har nu taget et afgørende skridt fremad på dette område:de har bestemt den tredimensionelle struktur af oligosaccharyltransferase (OST) i gær. "Dette er enzymet, der forbinder proteiner med sukkertræer, " forklarer Rebekka Wild, en af de tre hovedforfattere af rapporten i Videnskab hvor ETH-forskerne præsenterer deres resultater.
Det var ikke let at bestemme strukturen af OST:til at starte med, Jilliane Eyring, rapportens tredje hovedforfatter, modificerede gærcellerne, så enzymet kunne målrettes og renses. Wild måtte først udvinde enzymet, som er indlejret i en membran i cellen, fra store mængder af disse gærceller og derefter rense det i en møjsommelig procedure. "Ni liter gær producerede omkring 0,2 milligram enzym, " siger hun. OST-molekylerne blev påført et lille gitter, flash-frosset som individ, adskille partikler og afbildes ved hjælp af et højopløsnings kryo-elektronmikroskop.
Dette gav anledning til tusindvis af billeder, der viser enzymkomplekset fra alle mulige synsvinkler. Fra disse billeder, Julia Kowal, den anden hovedforfatter, genererede den tredimensionelle struktur af OST. Det tog seks uger at udføre beregningerne på computerklyngen. Resultatet var et kort over elektrondensitet, som viser enzymet som en "elektronsky."
"Vi greb et heldigt øjeblik, " forklarer Wild. De var i stand til at drage fordel af den "opløsningsrevolution", der i øjeblikket finder sted inden for kryo-elektronmikroskopi og gøre brug af et avanceret apparat med atomopløsning. Udviklingen af denne teknologi blev tildelt Nobelprisen i kemi i 2017.
For at fortolke elektronmikroskopidataene, Wild skulle passe aminosyresekvensen af OST "manuelt" ind i de små skyer i det tredimensionelle kort. Dermed, forskeren var i stand til at skildre 3D-strukturen af OST i fuld detalje – et gennembrud, der blev mødt med glæde blandt forskere, efter at det blev offentliggjort online.
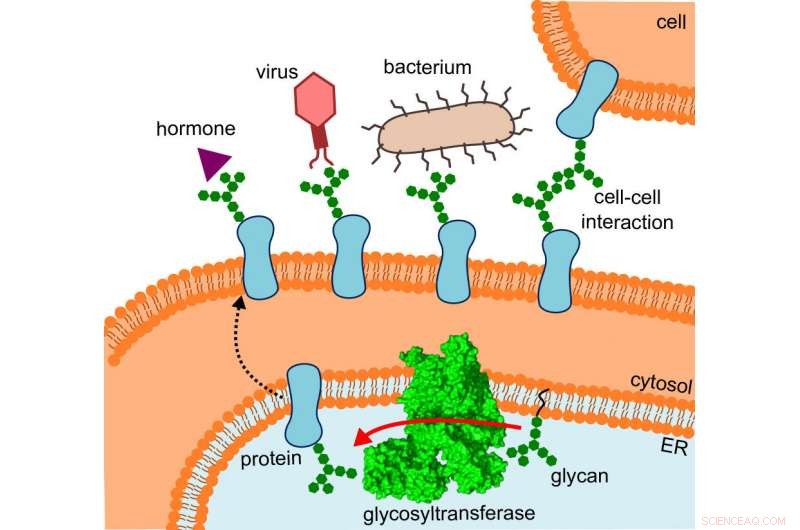
Diagrammet viser hvor glycosyltransferasen er placeret, den vej, de ændrede proteiner tager, og de interaktioner, de gennemgår. Kredit:R. Wild / ETH Zürich
OST er et membranproteinkompleks, der består af otte underenheder, som identificerer, for eksempel, sukker- eller proteinsubstraterne eller stabiliserer den katalytiske enhed. Sidstnævnte er underenheden af enzymet, der huser det aktive center, hvor proteiner og sukkerarter bringes sammen og smeltes sammen. "Vi havde forventet, at den katalytiske enhed var i midten af enzymet, "Forklarer Wild. "Overraskende nok, imidlertid, det er på ydersiden – og formen minder om en vidåben mund."
Det, der oprindeligt forvirrede forskerne, gav pludselig mening, da de monterede strukturen på det sted, hvor OST faktisk opererer:specifikt, enzymet er indlejret in vivo i membranen af det endoplasmatiske reticulum (ER). Dette er den del af cellen, hvor proteiner produceres, foldet, overvåget og ændret.
Her, OSTs direkte nabo er et tunnelprotein – det vidste man allerede. Dette tragter de spæde proteiner ind i det indre af det endoplasmatiske reticulum og derefter direkte ind i den vidt åbne mund af OST, hvor de modtager deres små sukkertræer.
"Gær OST er en god model for processerne i mennesker, Wild forklarer. Forskerne drager denne konklusion ud fra det faktum, at gær OSTs aktive center, hvor proteinerne er udstyret med sukker, ligner meget det tilsvarende område i bakterier. "Det betyder, at det aktive center næsten ikke har ændret sig i løbet af evolutionen, " forklarer forskeren, "hvilket betyder, at der er en god chance for, at det stadig fungerer på en meget lignende måde hos pattedyr, og derfor også hos mennesker."
Sidste artikelLys- og kobberkatalyse forbedrer aminsyntesen
Næste artikelForskning afslører mekanismen bag en vandspaltningskatalysator
 Varme artikler
Varme artikler
-
 Frøet, der kunne bringe rent vand til millioner(venstre) Uskallede M. oleifera frø, (mellem) afskallede frø, (til højre) knuste frø før proteinekstraktion Kredit:Carnegie Mellon University College of Engineering Ifølge FN, 2,1 milliarder menne
Frøet, der kunne bringe rent vand til millioner(venstre) Uskallede M. oleifera frø, (mellem) afskallede frø, (til højre) knuste frø før proteinekstraktion Kredit:Carnegie Mellon University College of Engineering Ifølge FN, 2,1 milliarder menne -
 Hvad er farverne på en ild og hvor varme er de?De hotteste flammer, der danser midt i bålene i et lejrbål, vises hvide med røde, der repræsenterer de fedeste flimre. Farvespillet i flammerne repræsenterer de forskellige stoffer, der gennemgår f
Hvad er farverne på en ild og hvor varme er de?De hotteste flammer, der danser midt i bålene i et lejrbål, vises hvide med røde, der repræsenterer de fedeste flimre. Farvespillet i flammerne repræsenterer de forskellige stoffer, der gennemgår f -
 Methanolsyntese:Indblik i strukturen af en gådefuld katalysatorCarbon-2-Chem-projektet sigter mod at anvende udstødningsgasser fra industrien på en gennemførlig måde. Kredit:RUB, Marquard Metanol er en af de vigtigste basiskemikalier, der bruges, for eksemp
Methanolsyntese:Indblik i strukturen af en gådefuld katalysatorCarbon-2-Chem-projektet sigter mod at anvende udstødningsgasser fra industrien på en gennemførlig måde. Kredit:RUB, Marquard Metanol er en af de vigtigste basiskemikalier, der bruges, for eksemp -
 Beskyttelse af probiotika fra mavenKredit:American Chemical Society Tyndtarmen er et arnested for mikrobiel aktivitet og et mål for probiotiske behandlinger mod diarré, inflammatorisk tarmsygdom og irritabel tyktarm, blandt andre f
Beskyttelse af probiotika fra mavenKredit:American Chemical Society Tyndtarmen er et arnested for mikrobiel aktivitet og et mål for probiotiske behandlinger mod diarré, inflammatorisk tarmsygdom og irritabel tyktarm, blandt andre f
- Sådan oprettes Punnett Squares
- Marsmåner i kredsløb antyder en gammel ring af Mars
- Narkotika gør rotter mindre tilbøjelige til at indtage alkohol
- Tour de France bevidst om at vinde sin egen grønne trøje
- En guide til pokersvindel – hvordan man ikke bliver stukket
- Ferroelektrisk fænomen vist sig levedygtigt for oxidelektroder, modbeviser forudsigelser


