Hvordan beregner du mol atomer i 9,00 g magnesiumnitrat?
1. Find den molære masse af magnesiumnitrat:
* Mg:24,31 g/mol
* N:14,01 g/mol (x 2 =28,02 g/mol)
* O:16,00 g/mol (x 6 =96,00 g/mol)
Samlet molmasse Mg (NO₃) ₂ =24,31 + 28,02 + 96,00 =148,33 g/mol
2. Beregn molen af magnesiumnitrat:
* mol =masse / molær masse
* mol =9,00 g / 148,33 g / mol
* mol =0,0607 mol mg (ingen₃) ₂
3. Bestem det samlede antal atomer pr. Molekyle:
* Et molekyle af Mg (NO₃) ₂ indeholder:
* 1 Magnesiumatom (MG)
* 2 nitrogenatomer (n)
* 6 iltatomer (O)
* I alt =9 atomer
4. Beregn molen af atomer:
* mol atomer =mol mg (ingen₃) ₂ * atomer pr. Molekyle
* mol atomer =0,0607 mol * 9 atomer/molekyle
* mol atomer =0,546 mol
Derfor er der ca. 0,546 mol atomer i 9,00 g magnesiumnitrat.
 Varme artikler
Varme artikler
-
 Teoretisk forudsigelse af omvendt intersystemkrydsning for organiske halvledereKredit:CC0 Public Domain Et fælles forskerhold ved RIKEN og Hokkaido University udviklede en metode til at forudsige hastighedskonstanter for reverse intersystem crossing (RISC) forbundet med lyse
Teoretisk forudsigelse af omvendt intersystemkrydsning for organiske halvledereKredit:CC0 Public Domain Et fælles forskerhold ved RIKEN og Hokkaido University udviklede en metode til at forudsige hastighedskonstanter for reverse intersystem crossing (RISC) forbundet med lyse -
 Video:Hvad er en elektron?Kredit:The American Chemical Society Når det kommer til elektroner - en af de grundlæggende byggesten i alt stof - er der masser af ubesvarede spørgsmål. Hvor store er de? Hvad er de lavet af? Hv
Video:Hvad er en elektron?Kredit:The American Chemical Society Når det kommer til elektroner - en af de grundlæggende byggesten i alt stof - er der masser af ubesvarede spørgsmål. Hvor store er de? Hvad er de lavet af? Hv -
 Naturens hårdeste stoffer afkodetEn illustration viser en model af blodplade-matrix-komposit i forgrunden og perlemor, et af naturens hårdeste materialer, i baggrunden. Rice University-forskere har udviklet computersimuleringer til a
Naturens hårdeste stoffer afkodetEn illustration viser en model af blodplade-matrix-komposit i forgrunden og perlemor, et af naturens hårdeste materialer, i baggrunden. Rice University-forskere har udviklet computersimuleringer til a -
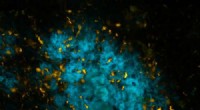 Skinnende molekyler skelner mellem proteiner i hjernenHjernevæv med Alzheimers patologi, farvet med et af de nye tau-specifikke molekyler (orange) og et af de molekyler, der tidligere er udviklet af gruppen ved LiU (blå). Billedet er taget i et fluoresce
Skinnende molekyler skelner mellem proteiner i hjernenHjernevæv med Alzheimers patologi, farvet med et af de nye tau-specifikke molekyler (orange) og et af de molekyler, der tidligere er udviklet af gruppen ved LiU (blå). Billedet er taget i et fluoresce
- Planter og dyr i løvskov
- Chokoladefysik:Hvordan modellering kunne forbedre 'mundfornemmelsen'
- Optisk interferometri visualiserer, hvor ofte liljer udsender flygtige organiske forbindelser
- Efter ulykker, Hollandske Uber løfter minimum chaufføralder
- Systemtilgang hjælper med at vurdere folkesundhedsvirkningerne af klimaændringer, miljøpolitik
- Solid forskning får fysikere til at foreslå en ny tilstand


