Hvorfor opfører metaller elektricitet i gasformig tilstand?
* Metallisk binding: Metallers evne til at udføre elektricitet i deres faste tilstand skyldes deres unikke metalliske binding. I metaller delokaliseres elektroner, hvilket betyder, at de ikke er tæt bundet til individuelle atomer, men kan bevæge sig frit gennem hele strukturen. Dette "hav" af elektroner giver mulighed for den lette strøm af elektrisk strøm.
* gasformig tilstand: I den gasformige tilstand er atomer langt fra hinanden, og den metalliske bindingsstruktur bryder sammen. Elektronerne er ikke længere delokaliserede og er tæt bundet til individuelle atomer. Dette betyder, at der ikke er nogen fri strøm af elektroner, og derfor ingen elektrisk ledningsevne.
Undtagelser:
Mens metaller ikke selv udfører elektricitet i den gasformige tilstand, er nogle ioniserede gasser , også kendt som plasma, kan udføre elektricitet. I plasmaer ioniseres nogle af atomerne, hvilket betyder, at de har mistet eller fået elektroner, hvilket resulterer i frie elektroner og ioner, der kan bære en elektrisk strøm. Dette er dog ikke en egenskab af metaller i deres gasformige tilstand.
Kortfattet: Metaller udfører elektricitet i deres faste tilstand på grund af deres metalliske binding. I den gasformige tilstand forstyrres den metalliske binding, og elektronerne er ikke længere frit til at bevæge sig, hvilket resulterer i en mangel på ledningsevne.
 Varme artikler
Varme artikler
-
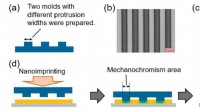 Forskning afslører kvantitative og højopløselige trykfunktioner af trykfølsomt materiale(a) Tværsnitsbillede af to siliciumforme. (b) Fotografier af en storskala siliciumform. (c) AFM billede af en smal skala silicium form. (d) Illustration til undersøgelse af rumlig opløsning ved hjælp
Forskning afslører kvantitative og højopløselige trykfunktioner af trykfølsomt materiale(a) Tværsnitsbillede af to siliciumforme. (b) Fotografier af en storskala siliciumform. (c) AFM billede af en smal skala silicium form. (d) Illustration til undersøgelse af rumlig opløsning ved hjælp -
 Metalisk femleddet ring flytter grænserne for aromaticitetProf. Dr. Robert Kretschmer, professor i uorganisk kemi ved Chemnitz University of Technology, undersøger krystaller foran et diffraktometer. Kredit:Jacob Müller | Chemnitz teknologiske universitet
Metalisk femleddet ring flytter grænserne for aromaticitetProf. Dr. Robert Kretschmer, professor i uorganisk kemi ved Chemnitz University of Technology, undersøger krystaller foran et diffraktometer. Kredit:Jacob Müller | Chemnitz teknologiske universitet -
 Teknologien bruger plantebiomasseaffald til selvdrevne biomedicinske enhederWenzhuo Wu, Ravi og Eleanor Talwar Rising Star, assisterende professor i industriteknik ved Purdues College of Engineering, er en innovator med fokus på at finde løsninger på tværs af flere discipline
Teknologien bruger plantebiomasseaffald til selvdrevne biomedicinske enhederWenzhuo Wu, Ravi og Eleanor Talwar Rising Star, assisterende professor i industriteknik ved Purdues College of Engineering, er en innovator med fokus på at finde løsninger på tværs af flere discipline -
 Metoden undersøger hurtigt atomtynde materialers evne til at producere brintEn teknik udviklet af Rice University og Los Alamos National Laboratory vil give forskere mulighed for hurtigt at undersøge atomtykke materialer for at måle brintproduktion. Rislaboratoriet bruger en
Metoden undersøger hurtigt atomtynde materialers evne til at producere brintEn teknik udviklet af Rice University og Los Alamos National Laboratory vil give forskere mulighed for hurtigt at undersøge atomtykke materialer for at måle brintproduktion. Rislaboratoriet bruger en
- Hvilken enhed bruges til at måle et kargarine kargarine?
- Hvilken faktor forklarer bedst, hvorfor klassifikationssystemet ændrer sig over tid A-skiftende mil…
- Hvad er en stationær lydkilde?
- Arktiske søer forsvinder i overraskende klimafund
- Måger:Sentinel af bakterier i miljøet
- Hvad var lanceringsdatoerne for Apollo 9?


