Hvad er eksemplerne på isotoper?
Hydrogen:
* Protium (¹H): Den mest almindelige isotop med en proton og ingen neutroner.
* deuterium (²h): Indeholder en proton og en neutron. Det bruges i nuklear fusionsforskning.
* tritium (³h): Indeholder en proton og to neutroner. Det er radioaktivt og bruges i nogle applikationer som Tritium-baserede lyskilder.
carbon:
* carbon-12 (¹²c): Den mest almindelige isotop med seks protoner og seks neutroner. Det danner grundlaget for atommasseenheden.
* carbon-14 (¹⁴c): Radioaktiv med seks protoner og otte neutroner. Brugt i kulstofdatering til at bestemme alderen for gamle artefakter.
ilt:
* ilt-16 (¹⁶o): Den mest rigelige isotop med otte protoner og otte neutroner.
* ilt-18 (¹⁸o): Brugt i Paleoclimate -forskning til at studere tidligere temperaturer.
uran:
* uranium-235 (²³⁵u): Fissile isotop brugt i atomkraftværker og våben.
* uranium-238 (²³⁸u): Mest rigelige naturlige uranisotop. Brugt i atomkraftværker, men ikke fissile.
Andre eksempler:
* kalium-40 (⁴⁰k): Radioaktiv isotop fundet i bananer og brugt i kalium-argon-datering.
* chlor-35 (³⁵cl) og chlor-37 (³⁷cl): Begge forekommer naturligt og bidrager til den gennemsnitlige atommasse af klor.
* cobalt-60 (⁶⁰co): Radioaktiv isotop anvendt i medicinsk strålebehandling.
* jod-131 (¹³¹i): Radioaktiv isotop anvendt i skjoldbruskkirtelbehandlinger og medicinsk billeddannelse.
Nøgle takeaways:
* Isotoper af et element har det samme antal protoner, men forskellige antal neutroner. Dette fører til variationer i deres atommasse.
* Nogle isotoper er radioaktive , mens andre er stabile.
* isotoper har forskellige applikationer inden for områder som medicin, arkæologi og energiproduktion.
 Varme artikler
Varme artikler
-
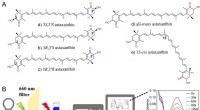 Forskelle fundet i antioxidantaktiviteter af astaxanthinisomerer mod singlet oxygen(A) Strukturer af stereoisomerer af astaxanthin. (B) Måling af singlet-iltslukningskapaciteten af antioxidanter. Kredit:Zheng Xinxin For nylig foreslog forskere ledet af prof. Huang Qing fra Inst
Forskelle fundet i antioxidantaktiviteter af astaxanthinisomerer mod singlet oxygen(A) Strukturer af stereoisomerer af astaxanthin. (B) Måling af singlet-iltslukningskapaciteten af antioxidanter. Kredit:Zheng Xinxin For nylig foreslog forskere ledet af prof. Huang Qing fra Inst -
 Rettelse til synkrotronforskningsfejl kan forbedre resultaterneKurt Nienaber (tv) og Graham George. Kredit:University of Saskatchewan Forskere fra University of Saskatchewan har fundet ud af, at kemikalier, der normalt bruges til at beskytte prøver i synkrotr
Rettelse til synkrotronforskningsfejl kan forbedre resultaterneKurt Nienaber (tv) og Graham George. Kredit:University of Saskatchewan Forskere fra University of Saskatchewan har fundet ud af, at kemikalier, der normalt bruges til at beskytte prøver i synkrotr -
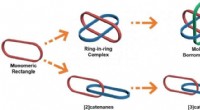 Alt-i-én-strategi for metalla[3]catenaner, Borromæiske ringe og ring-i-ring kompleksForskellige sammenlåste strukturer:monomert rektangel; ring-i-ring kompleks; Borromæiske ringe; [2]catenaner; lineære [3]catenaner. Kredit:Science China Press Sammenlåste molekylære arter har fået
Alt-i-én-strategi for metalla[3]catenaner, Borromæiske ringe og ring-i-ring kompleksForskellige sammenlåste strukturer:monomert rektangel; ring-i-ring kompleks; Borromæiske ringe; [2]catenaner; lineære [3]catenaner. Kredit:Science China Press Sammenlåste molekylære arter har fået -
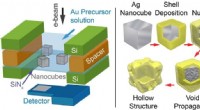 Realtidsbillede af kemiske processer(Venstre) Figur viser en skematisk af in situ LC-TEM opsætningen involverer sølv (Ag) nanokuber i en opløsning af guld (Au) ioner. (Til højre) Mekanisme, der viser den strukturelle transformation unde
Realtidsbillede af kemiske processer(Venstre) Figur viser en skematisk af in situ LC-TEM opsætningen involverer sølv (Ag) nanokuber i en opløsning af guld (Au) ioner. (Til højre) Mekanisme, der viser den strukturelle transformation unde
- Hvad gør ethanol i en DNA-ekstraktion?
- Ny fotokatalysator producerer ammoniak fra atmosfærisk nitrogen ved stuetemperatur uden fossile bræ…
- Flyvende biler foreslået til Paris offentlige transportnet
- Nanokatalysatorer, der fjernstyrer kemiske reaktioner inde i levende celler
- Kina gennemfører den første havbaserede rumraketopsendelse
- Større er anderledes - den usædvanlige fysik af mekaniske metamaterialer udsat


