Hvordan en proton bidrager til den samlede masse af et atom?
* masse af en proton: Protoner har en masse på cirka 1 atommasseenhed (AMU). Dette er en meget lille masseenhed, men den er betydelig på atomniveau.
* atommasse: Atommassen af et atom bestemmes primært af antallet af protoner og neutroner i dens kerne.
* Neutrons rolle: Neutroner har også en masse på cirka 1 amu.
* Elektrons rolle: Elektroner er meget mindre end protoner og neutroner med en masse på kun ca. 1/1836 amu. Deres bidrag til den samlede masse af et atom er ubetydelig.
Kortfattet:
* Protoner bidrager væsentligt til den samlede masse af et atom , der udgør omkring halvdelen af den samlede atommasse (sammen med neutroner).
* Antallet af protoner (atomnummer) definerer elementet , mens det samlede antal protoner og neutroner (masseantal) bestemmer den specifikke isotop af dette element.
Eksempel:
* carbon-12 Har 6 protoner og 6 neutroner. Dens atommasse er cirka 12 amu (6 protoner + 6 neutroner). Elektronernes masse er ubetydelig i denne beregning.
Sidste artikelHar en Nutron positiv eller negativ ladning?
Næste artikelHvad er eksemplerne på isotoper?
 Varme artikler
Varme artikler
-
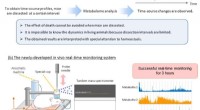 Realtidsdækning af hjernens indre muliggjortFig. 1 Forskelle mellem konventionel metabolomanalyse for dissekerede hjerneprøver og det nyudviklede in vivo realtidsovervågningssystem. Kredit:Nagoya University Overvågning i realtid af dynamikk
Realtidsdækning af hjernens indre muliggjortFig. 1 Forskelle mellem konventionel metabolomanalyse for dissekerede hjerneprøver og det nyudviklede in vivo realtidsovervågningssystem. Kredit:Nagoya University Overvågning i realtid af dynamikk -
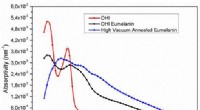 Vil cyborgs blive lavet af melanin? Pigmentgennembrud muliggør biokompatibel elektronikUV-Vis absorptionsevne (procent absorbans/filmtykkelse) af filmene på de forskellige procestrin:(rød, cirkler) DHI; (sort, firkanter) DHI-eumelanin (film efter AISSP); (blå, trekanter) HVAE (film efte
Vil cyborgs blive lavet af melanin? Pigmentgennembrud muliggør biokompatibel elektronikUV-Vis absorptionsevne (procent absorbans/filmtykkelse) af filmene på de forskellige procestrin:(rød, cirkler) DHI; (sort, firkanter) DHI-eumelanin (film efter AISSP); (blå, trekanter) HVAE (film efte -
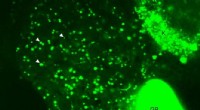 Forskere ser fedtstofskiftet i levende fisk, observere lipidbiokemi i realtidEt levende billede af leveren af en gennemskinnelig, larve zebrafisk. Det er taget ved hjælp af konfokal mikroskopi, som giver mulighed for klare billeder af de indre organer af et helt levende dyr.
Forskere ser fedtstofskiftet i levende fisk, observere lipidbiokemi i realtidEt levende billede af leveren af en gennemskinnelig, larve zebrafisk. Det er taget ved hjælp af konfokal mikroskopi, som giver mulighed for klare billeder af de indre organer af et helt levende dyr. -
 Bæredygtigt vandbehandlingssystem inspireret af naturenStand Alone Sunflow System. Kredit:Monash University Studerende fra Monash Chemical Engineering har brugt den naturlige vandbehandlingscyklus fundet i naturen som inspiration til at udvikle en bær
Bæredygtigt vandbehandlingssystem inspireret af naturenStand Alone Sunflow System. Kredit:Monash University Studerende fra Monash Chemical Engineering har brugt den naturlige vandbehandlingscyklus fundet i naturen som inspiration til at udvikle en bær
- Græskarfarme tilpasser sig for at forbedre jorden, sænke emissionerne
- Hudsårregenerering med bioaktiv glas-guld nanopartikelsalve
- Touchscreen-alternativ dæmper frygten for verdensmangel på indium
- Hvad er højden på Ross Ice -hylde i Antarktis?
- Hvilke to stoffer bruges som moderatorer i atomreaktorer?
- Løsning af et mysterium:En ny model til at forstå, hvordan visse kerner splittes


