Ikke befugtning af saltbroen med 0,1 m KNO3?
Betydningen af saltbroen:
* færdiggørelse af kredsløbet: Saltbroen fungerer som en vigtig forbindelse mellem de to halvceller i en elektrokemisk celle. Det giver ioner mulighed for at strømme fra den ene halvcelle til den anden, opretholde elektrisk neutralitet og lade den elektrokemiske reaktion fortsætte.
* Forebyggelse af opbygning af gebyr: Hvis saltbroen ikke er til stede, ville opbygningen af ladning inden for hver halvcelle hurtigt stoppe strømmen af elektroner og reaktionen.
Hvad sker der, hvis du ikke vådes saltbroen?
* ingen ionstrøm: Uden en ledende sti gennem saltbroen kan ioner ikke strømme for at afbalancere ladningen. Dette betyder, at den elektrokemiske reaktion ikke kan fortsætte.
* Elektrokemisk potentiel forstyrrelse: Opbygningen af ladning i halvcellerne vil forstyrre den elektrokemiske potentialeforskel mellem de to elektroder, hvilket gør cellen ubrugelig.
* Forkert måling af cellepotentiale: Hvis du måler cellepotentialet, vil en uudviklet saltbro føre til unøjagtige og upålidelige aflæsninger.
Sådan vådes saltbroen korrekt:
1. Brug den korrekte løsning: Brug altid elektrolytopløsningen, der er specificeret til din særlige elektrokemiske celle (normalt KNO3, KCL eller andre egnede saltopløsninger).
2. nedsænkning: Sørg for, at saltbroen er fuldt nedsænket i elektrolytopløsningen. Enderne af saltbroen skal være nedsænket i opløsningerne af begge halvceller.
3. Undgå luftbobler: Sørg for, at der ikke er nogen luftbobler fanget i Salt Bridge. Disse kan afbryde strømmen af ioner.
Sammenfattende er befugtning af saltbroen absolut vigtig for korrekt funktion af en elektrokemisk celle. Det tillader strømmen af ioner, opretholder elektrisk neutralitet og sikrer, at reaktionen kan fortsætte som tilsigtet.
Sidste artikelHvilken periode findes kobber i?
Næste artikelHvad er formålet med Salt Bridge i en elektrokemisk celle?
 Varme artikler
Varme artikler
-
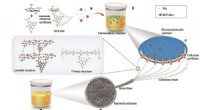 Forskere bruger mikroorganismer til at fremstille funktionel bakteriel cellulose in situGlucose (Glc) blev modificeret med 6CF, og 6CF-Glc blev brugt som en kulstofkilde til K. sucrofermentans fermentering for at opnå 6CF-BC gennem mikrobielle metaboliske veje Kredit:GAO Minghong Bak
Forskere bruger mikroorganismer til at fremstille funktionel bakteriel cellulose in situGlucose (Glc) blev modificeret med 6CF, og 6CF-Glc blev brugt som en kulstofkilde til K. sucrofermentans fermentering for at opnå 6CF-BC gennem mikrobielle metaboliske veje Kredit:GAO Minghong Bak -
 Nylon som byggesten til gennemsigtige elektroniske enheder?Gennemsigtig nylon kan være en vigtig byggesten for udviklingen af transparente elektroniske kredsløb i fremtiden. Kredit:MPI-P Forskere ved Max Planck Institute for Polymer Research (MPI-P) led
Nylon som byggesten til gennemsigtige elektroniske enheder?Gennemsigtig nylon kan være en vigtig byggesten for udviklingen af transparente elektroniske kredsløb i fremtiden. Kredit:MPI-P Forskere ved Max Planck Institute for Polymer Research (MPI-P) led -
 Kemikere gør hård plast genanvendeligKredit:Unsplash/CC0 Public Domain Termosæt, som omfatter epoxy, polyurethaner, og gummi brugt til dæk, findes i mange produkter, der skal være holdbare og varmebestandige, såsom biler eller elektr
Kemikere gør hård plast genanvendeligKredit:Unsplash/CC0 Public Domain Termosæt, som omfatter epoxy, polyurethaner, og gummi brugt til dæk, findes i mange produkter, der skal være holdbare og varmebestandige, såsom biler eller elektr -
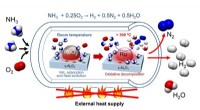 Katalysator til kulstoffri produktion af brintgas fra ammoniakKredit:Katsutoshi Nagaoka (Phys.org)—Hydrogen har potentialet til at give et alternativ, ren energikilde, især når det gælder brændselscelleteknologi. Nuværende brændstofkilder involverer kulstofh
Katalysator til kulstoffri produktion af brintgas fra ammoniakKredit:Katsutoshi Nagaoka (Phys.org)—Hydrogen har potentialet til at give et alternativ, ren energikilde, især når det gælder brændselscelleteknologi. Nuværende brændstofkilder involverer kulstofh
- Karakteristik af protozoer og alger
- Hvordan to jordbaserede teleskoper understøtter NASAs Cassini-mission
- Astronomer undersøger radioburst-emission fra magnetaren XTE J1810−197
- Ansigtsgenkendelse bliver tilvalgsfunktion på Facebook
- Hvad betyder en koncentreret svag syre?
- Ny undersøgelse afslører ladningsoverførsel ved grænsefladen mellem spineloxid og ceriumoxid und…


