Hvad er formålet med Salt Bridge i en elektrokemisk celle?
Her er en sammenbrud af, hvordan det fungerer:
* redoxreaktioner: Elektrokemiske celler fungerer efter princippet om redoxreaktioner. Den ene halvcelle gennemgår oxidation (tab af elektroner), mens den anden gennemgår reduktion (forstærkning af elektroner).
* Elektronstrøm: Elektroner strømmer fra anoden (hvor oxidation forekommer) til katoden (hvor reduktion forekommer) gennem et eksternt kredsløb. Dette skaber en elektrisk strøm.
* ubalance: Denne elektronstrøm forlader anoden med et overskud af positiv ladning og katoden med et overskud af negativ ladning. Uden en saltbro ville denne ladning ubalance hurtigt standse reaktionen, da den ville modsætte sig yderligere elektronstrøm.
* saltbroopløsning: Saltbroen er fyldt med en elektrolytopløsning, der normalt indeholder en stærk elektrolyt med inerte ioner som kaliumchlorid (KCL). Disse ioner er mobile og kan migrere inden i Salt Bridge.
* Vedligeholdelse af neutralitet: Når anoden bliver positivt ladet, migreres negativt ladede ioner fra saltbroen (som Cl-) ind i anoden halvcelle for at neutralisere den positive ladning. Tilsvarende migrerer positivt ladede ioner fra saltbroen (som K+) ind i katoden halvcelle for at neutralisere den negative ladning.
* Kredsløbsafslutning: Denne bevægelse af ioner afslutter kredsløbet, hvilket gør det muligt for den elektrokemiske reaktion at fortsætte.
I det væsentlige fungerer Salt Bridge som en ledning for strømmen af ioner, afbalancering af ladningsopbygningen i halvcellerne og forhindre den elektrokemiske reaktion i at stoppe.
Uden saltbroen ville den elektrokemiske celle hurtigt blive polariseret, hvilket betyder, at den potentielle forskel mellem elektroderne ville falde, og strømmen ville falde, hvilket gør cellen ubrugelig.
 Varme artikler
Varme artikler
-
 Brug af guldpartikler til at gøre det usynlige synligtKredit:Leiden Universitet Guld nanopartikler giver os en bedre forståelse af enzymer og andre molekyler. Biswajit Pradhan, Ph.d. kandidat ved Leiden Institute of Physics, bruger guld nanorods til
Brug af guldpartikler til at gøre det usynlige synligtKredit:Leiden Universitet Guld nanopartikler giver os en bedre forståelse af enzymer og andre molekyler. Biswajit Pradhan, Ph.d. kandidat ved Leiden Institute of Physics, bruger guld nanorods til -
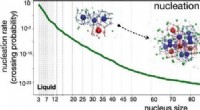 Hastighedsforudsigelse for homogen kernedannelse af methanhydratKredit:HIMS Metanhydrater er den største enkeltkilde til fossilt brændstof på planeten jorden og spiller en rolle i klimaændringer. Den molekylære proces af deres dannelse er ikke kendt og stærkt
Hastighedsforudsigelse for homogen kernedannelse af methanhydratKredit:HIMS Metanhydrater er den største enkeltkilde til fossilt brændstof på planeten jorden og spiller en rolle i klimaændringer. Den molekylære proces af deres dannelse er ikke kendt og stærkt -
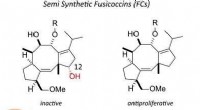 Redigeret plantebaseret toksin besidder antitumoregenskaberFusicoccin, et fytotoksin, blev omdannet til en række antiproliferative midler til tumorceller ved at fjerne 12-hydroxylgruppen. Disse forbindelser blev vist at opregulere interaktion mellem 1433 og e
Redigeret plantebaseret toksin besidder antitumoregenskaberFusicoccin, et fytotoksin, blev omdannet til en række antiproliferative midler til tumorceller ved at fjerne 12-hydroxylgruppen. Disse forbindelser blev vist at opregulere interaktion mellem 1433 og e -
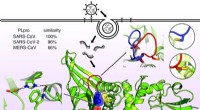 Information om molekylær form af vira, der forårsager COVID-19, SARS, og MERS afslører strukturel…Molekylær struktur af det papainlignende enzym kendt som PLPro. Dette enzym tillader de vira, der forårsager SARS, MERS, og COVID-19 for at inficere celler og replikere og undertrykke værtens immunfun
Information om molekylær form af vira, der forårsager COVID-19, SARS, og MERS afslører strukturel…Molekylær struktur af det papainlignende enzym kendt som PLPro. Dette enzym tillader de vira, der forårsager SARS, MERS, og COVID-19 for at inficere celler og replikere og undertrykke værtens immunfun
- Er H O N og Br kiselalger i kemi?
- Hvorfor forekommer en solformørkelse kun under New Moon Lunar Full Moon?
- Hvad er kulstofs oxidationstilstand for ionisk ladning?
- Fejlrettelse betyder, at Californiens fremtidige vådere vintre måske aldrig kommer
- En Titan-mission kunne tanke brændstof på stedet og returnere en prøve til Jorden
- Gamle potter har spor om, hvordan forskelligartede diæter hjalp hyrderne til at trives i det sydlig…


