Hvilke faktorer kan påvirke opløseligheden?
1. Natur af opløst stof og opløsningsmiddel:
* "som opløser som": Dette grundlæggende princip siger, at stoffer med lignende polariteter (polær opløser polære, ikke -polære opløser ikke -polære) har en tendens til at opløses i hinanden. For eksempel er vand (polær) et godt opløsningsmiddel til sukker (polær), men ikke for olie (ikke -polær).
* Intermolekylære kræfter: Jo stærkere de attraktive kræfter mellem opløst stof og opløsningsmiddelmolekyler (f.eks. Hydrogenbinding, dipol-dipolinteraktioner), desto mere sandsynligt er det at det er at blande og opløses.
2. Temperatur:
* Generelt bliver faste stoffer og væsker mere opløselige, når temperaturen øges. Dette skyldes, at højere temperaturer giver mere energi til at bryde bindingerne, der holder opløsningen sammen, og give det mulighed for bedre at interagere med opløsningsmiddeltemaerne.
* Gasser opfører sig forskelligt: Deres opløselighed falder, når temperaturen øges. Dette skyldes, at højere temperaturer tillader gasmolekyler at overvinde opløsningsmidlets attraktive kræfter og flygte ud i atmosfæren.
3. Tryk:
* Tryk påvirker primært opløseligheden af gasser: Stigende tryk øger opløseligheden af gasser. Dette skyldes, at højere tryk tvinger flere gasmolekyler til opløsning. Dette er grunden til, at kulsyreholdige drikkevarer fizz, når de åbnes - trykket frigøres, og det opløste kuldioxid slipper ud.
4. Partikelstørrelse:
* mindre partikler opløses hurtigere: Mindre partikler har et større overfladeareal udsat for opløsningsmidlet, hvilket giver mulighed for hurtigere interaktion og opløsning.
5. Agitation:
* omrøring eller ryste øges opløselighed: Agitation hjælper med at sprede de opløste partikler og bringer friske opløsningsmiddelmolekyler i kontakt med opløsningen og fremskynder opløsningsprocessen.
6. Tilstedeværelse af andre opløste stoffer:
* Tilstedeværelsen af andre opløste stoffer kan påvirke opløselighed: For eksempel kan tilsætning af salt til vand reducere opløseligheden af nogle gasser, som ilt.
7. Kemiske reaktioner:
* Nogle opløste stoffer reagerer med opløsningsmidlet: Dette kan enten øge eller mindske opløseligheden afhængigt af reaktionens art. For eksempel kan tilsætning af en syre til vand øge opløseligheden af nogle metaller.
8. Koncentration:
* opløselighed er en grænse: Mens forøgelse af koncentrationen af opløst stoffet kan øge mængden af opløst stof, der opløses oprindeligt, er der en grænse. Ud over denne grænse bliver opløsningen mættet, og ikke mere opløst stof kan opløses.
9. Polaritet:
* polære forbindelser opløses i polære opløsningsmidler og vice versa: Dette skyldes de lignende interaktioner mellem molekylerne. For eksempel er vand et polært opløsningsmiddel og opløser polære forbindelser som sukker og salt. Ikke -polære forbindelser, som olie, opløses i ikke -polære opløsningsmidler som hexan.
Disse faktorer kan interagere på komplekse måder at påvirke opløselighed på. At forstå dem giver os mulighed for at forudsige og kontrollere opløseligheden af forskellige stoffer i forskellige situationer.
 Varme artikler
Varme artikler
-
 Kemisk innovation stabiliserer den bedst ydende perovskit-formuleringUdgiver i Videnskab , forskere ved EPFL har med succes overvundet et begrænsende problem med at stabilisere den bedst ydende formulering af metalhalogenid perovskitfilm, en nøglespiller i en række a
Kemisk innovation stabiliserer den bedst ydende perovskit-formuleringUdgiver i Videnskab , forskere ved EPFL har med succes overvundet et begrænsende problem med at stabilisere den bedst ydende formulering af metalhalogenid perovskitfilm, en nøglespiller i en række a -
 Æg-baserede influenzavacciner:Ikke alle, de er oplagte til at være?Kredit:CC0 Public Domain Influenzasæsonen er i gang på den nordlige halvkugle, gør millioner af mennesker syge og i sjældne tilfælde, forårsage hospitalsindlæggelse eller død. Den bedste forebygge
Æg-baserede influenzavacciner:Ikke alle, de er oplagte til at være?Kredit:CC0 Public Domain Influenzasæsonen er i gang på den nordlige halvkugle, gør millioner af mennesker syge og i sjældne tilfælde, forårsage hospitalsindlæggelse eller død. Den bedste forebygge -
 Brug af metaller til brændstofKredit:Pixabay/CC0 Public Domain Vidste du, at vi inden for mikrotyngdekraft forbereder et af de mest lovende brændstoffer til fremtiden? Mikrotyngdekraft hjælper med at finde svar og modeller ti
Brug af metaller til brændstofKredit:Pixabay/CC0 Public Domain Vidste du, at vi inden for mikrotyngdekraft forbereder et af de mest lovende brændstoffer til fremtiden? Mikrotyngdekraft hjælper med at finde svar og modeller ti -
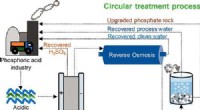 Forskere udvikler en metode til at omdanne farligt surt industrispildevand til værdifulde ressource…Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.2c03132 Et forskerhold af miljøforskere fra Ben-Gurion University of the Negev har udviklet en cirkulær proces til at
Forskere udvikler en metode til at omdanne farligt surt industrispildevand til værdifulde ressource…Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.2c03132 Et forskerhold af miljøforskere fra Ben-Gurion University of the Negev har udviklet en cirkulær proces til at
- Hvilken stjerne har den største sandsynlighed for at producere en supernova -eksplosion?
- Rusland tager hård hånd til internettet for at blokere beskedapp (Opdatering)
- Høste vedvarende energi fra solen og det ydre rum på samme tid
- Sådan virker influenza
- Alphabet passerer Apple som største virksomhed - hvad nu?
- Bioinspireret proces gør materialer lette, robust, programmerbar på nano- til makro-skala


