Hvorfor den vandige opløsning af calciumhydroxid bliver sløret, når du sender kuldioxid ind i det?
1. Calciumhydroxid (Limewater):
* Calciumhydroxid er en svag base, og dets vandige opløsning er kendt som kalkvand.
* Limewater er klar og farveløst.
2. Reaktion med kuldioxid:
* Når kuldioxidgas bobles gennem kalkvand, reagerer det med calciumhydroxidet for at danne calciumcarbonat (Caco₃) og vand (H₂O).
* Den kemiske ligning for denne reaktion er:
`` `
CA (OH) ₂ (aq) + co₂ (g) → caco₃ (s) + h₂o (l)
`` `
3. Dannelse af bundfaldet:
* Calciumcarbonat (caco₃) er et uopløseligt hvidt fast stof. Dette betyder, at det ikke opløses godt i vand.
* Efterhånden som reaktionen skrider frem, udfældes den uopløselige calciumcarbonat ud af opløsningen og danner en mælkehvid ophæng.
4. Sløret udseende:
* Suspensionen af små calciumcarbonatpartikler spreder lys i alle retninger, hvilket får opløsningen til at virke overskyet eller sløret.
Kortfattet:
Kuldioxid reagerer med calciumhydroxid og producerer et hvidt bundfald af calciumcarbonat. Dette bundfald gør løsningen overskyet og uigennemsigtig, hvilket fører til det slørede udseende.
Sidste artikelEr zinkphosphid et metallisk salt?
Næste artikelHvad er koncentration på 150 g calciumcarbonat i 850 ml vand?
 Varme artikler
Varme artikler
-
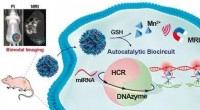 Amplifikation og billeddannelse af microRNA som en biomarkør for at påvise tumorudviklingKredit:Wiley-VCH/ Angewandte Chemie En god indikator for dysregulering i levende celler er en ændring i deres RNA -ekspression. MicroRNA (miRNA), en særlig type RNA, betragtes som en biomarkør f
Amplifikation og billeddannelse af microRNA som en biomarkør for at påvise tumorudviklingKredit:Wiley-VCH/ Angewandte Chemie En god indikator for dysregulering i levende celler er en ændring i deres RNA -ekspression. MicroRNA (miRNA), en særlig type RNA, betragtes som en biomarkør f -
 Mat lokkemad, kroger og ødelægger forurenende stoffer i vandPletter af titaniumdioxid klæber til polyvinylfibre i en måtte udviklet på det Rice University-ledede NEWT Center for at opfange og ødelægge forurenende stoffer fra spildevand eller drikkevand. Efter
Mat lokkemad, kroger og ødelægger forurenende stoffer i vandPletter af titaniumdioxid klæber til polyvinylfibre i en måtte udviklet på det Rice University-ledede NEWT Center for at opfange og ødelægge forurenende stoffer fra spildevand eller drikkevand. Efter -
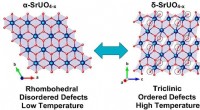 Brug af uran til at skabe orden fra uordenKredit:Australian Nuclear Science and Technology Organization (ANSTO) ANSTOs unikke skelsættende infrastruktur er blevet brugt til at undersøge uran, nøglen til atombrændstofcyklussen. De avancere
Brug af uran til at skabe orden fra uordenKredit:Australian Nuclear Science and Technology Organization (ANSTO) ANSTOs unikke skelsættende infrastruktur er blevet brugt til at undersøge uran, nøglen til atombrændstofcyklussen. De avancere -
 Flydende platin ved stuetemperatur:Den seje katalysator for en bæredygtig revolution inden for indu…Flydende gallium- og platinperler tæt på. Kredit:Dr. Md. Arifur Rahim, UNSW Sydney. Forskere i Australien har været i stand til at bruge spormængder af flydende platin til at skabe billige og højef
Flydende platin ved stuetemperatur:Den seje katalysator for en bæredygtig revolution inden for indu…Flydende gallium- og platinperler tæt på. Kredit:Dr. Md. Arifur Rahim, UNSW Sydney. Forskere i Australien har været i stand til at bruge spormængder af flydende platin til at skabe billige og højef
- Er rustende hjul på en cykel kemisk eller fysisk?
- Ny teknik kan gøre modellering af molekyler meget lettere
- Høj effektivitet, billig katalysator til vandelektrolyse
- Forskere finder hidtil uset dyb oxidativ afsvovling med præcist designede Ti-steder
- Eksperimenter med solens temperatur tilbyder løsninger på solmodelproblemer
- Status for proteiner, der huser DNA, styrer, hvordan celler opretholder identitet


