Hvorfor giver 1-chlorobutan et bundfald, mens I-iodopropan ikke er, når den reageres med natriumiodid i acetone, selvom begge primært er alkylhalogenid?
Her er sammenbruddet:
* SN2 -reaktioner: Disse reaktioner involverer en nukleofil (som iodidion), der angriber et elektrofil carbonatom, hvilket fører til forskydning af en forladt gruppe (halogenid).
* forlader gruppeevne: Den efterladte gruppes evne til at forlade er afgørende for, at reaktionen fortsætter. iodid (I-) er en meget bedre forlader gruppe end chlorid (Cl-) . Dette skyldes, at jod er større og mere polariserbar, hvilket gør C-I-bindingen svagere og lettere at bryde.
* reaktionen:
* 1-chlorobutane: Mens reaktionen kan forekomme, er C-CL-bindingen relativt stærk, hvilket gør reaktionen langsommere. Det bundfald (formodentlig natriumchlorid, NaCl) dannes langsomt.
* 1-iodopropan: C-I-bindingen er svagere, og iodidionen er en bedre forlader-gruppe. Reaktionen fortsætter meget hurtigere, danner natriumiodid (NAI) præcipitat letter.
Kortfattet: Forskellen i reaktivitet skyldes halogenernes forladte gruppe. Iodid er en bedre forladt gruppe end chlorid, hvilket fører til en hurtigere reaktion med natriumiodid i acetone og et lettere dannet bundfald.
Fortæl mig, hvis du har yderligere spørgsmål!
Sidste artikelHvilket produkt dannes på brændende magnesiumbånd?
Næste artikelEr nogle metalloider gasser ved stuetemeratur?
 Varme artikler
Varme artikler
-
 Skriv med varme, afkøles og gentag derefter med genskrivbart papirBilledet på dette mobiltelefoncover kan ændre sig, fordi det er lavet med genskrivbart papir. Kredit:American Chemical Society Selv i denne digitale tidsalder, papir er stadig overalt. Tit, trykte
Skriv med varme, afkøles og gentag derefter med genskrivbart papirBilledet på dette mobiltelefoncover kan ændre sig, fordi det er lavet med genskrivbart papir. Kredit:American Chemical Society Selv i denne digitale tidsalder, papir er stadig overalt. Tit, trykte -
 Kompositmetalskum tager varmen, rykke tættere på udbredte applikationerStål-stål kompositmetalskumprøver før test (højre) og efter 100 minutters eksponering for 825C (venstre). Kredit:Afsaneh Rabiei, NC State University Forskere fra North Carolina State University ha
Kompositmetalskum tager varmen, rykke tættere på udbredte applikationerStål-stål kompositmetalskumprøver før test (højre) og efter 100 minutters eksponering for 825C (venstre). Kredit:Afsaneh Rabiei, NC State University Forskere fra North Carolina State University ha -
 Belysning af stien for cellerNeuroner følger det kortlagte mønster i en hydrogel. Kredit:ETH Zürich ETH -forskere har udviklet en ny metode, hvor de bruger lys til at tegne mønstre af molekyler, der styrer levende celler. Fre
Belysning af stien for cellerNeuroner følger det kortlagte mønster i en hydrogel. Kredit:ETH Zürich ETH -forskere har udviklet en ny metode, hvor de bruger lys til at tegne mønstre af molekyler, der styrer levende celler. Fre -
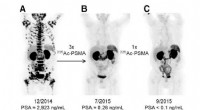 Hvordan forskere opdagede en ny måde at producere actinium-225, en sjælden medicinsk radioisotopDette billede viser tre forskellige billeder af en enkelt patient med prostatakræft i slutstadiet. Den første blev taget før behandling med actinium-225, den anden efter tre doser, og den tredje efter
Hvordan forskere opdagede en ny måde at producere actinium-225, en sjælden medicinsk radioisotopDette billede viser tre forskellige billeder af en enkelt patient med prostatakræft i slutstadiet. Den første blev taget før behandling med actinium-225, den anden efter tre doser, og den tredje efter
- Forskere forbedrer prognosen for stigende fare på den ecuadorianske vulkan
- Hvad er navnet på topoverfladezonemætning?
- Hvad kalder du en hård ydre skeletskal?
- Hvor mange molekyler er der på Jorden?
- Hvilken effekt vil nordpolen af en magnet have på en anden magnet?
- Hvorfor stadig brug for affald i en cirkulær økonomi


