Hvilke kemiske reaktioner er den type kemikalier, der brydes,?
Typer af kemiske bindinger
* ioniske bindinger: Dannet af den elektrostatiske tiltrækning mellem modsat ladede ioner. Disse stammer fra fuldstændig overførsel af elektroner mellem atomer.
* kovalente obligationer: Dannet ved deling af elektroner mellem atomer. Disse kan være:
* ikke -polær kovalent: Elektroner deles ligeligt mellem atomer (f.eks. H₂).
* polær kovalent: Elektroner deles ulige, hvilket fører til en delvis positiv og delvis negativ ladning på atomerne (f.eks. H₂O).
* Metalliske obligationer: Fundet i metaller, hvor elektroner delokaliseres og bevæger sig frit gennem metalgitteret.
Kemiske reaktioner og obligationsbrud
Kemiske reaktioner involverer brud og dannelse af kemiske bindinger. Her er en sammenbrud:
* Breaking Bonds: For at starte en kemisk reaktion er der behov for energi for at bryde eksisterende bindinger. Denne energi kan komme fra varme, lys eller andre kilder.
* Formning af obligationer: Når obligationer går i stykker, dannes nye obligationer og frigiver energi.
Eksempler på kemiske reaktioner og bindingstyper
1. forbrænding: Forbrænding af brændstoffer som træ eller propan involverer brud på kovalente bindinger inden for brændstofmolekylerne og dannelsen af nye bindinger med ilt for at skabe kuldioxid og vand.
2. neutralisering: Reaktionen mellem en syre (f.eks. HCI) og en base (f.eks. NaOH) involverer brud på ioniske bindinger i både reaktanter og dannelsen af nye ioniske bindinger for at skabe salt (NaCl) og vand (H₂O).
3. Fotosyntese: Planter bruger sollys til at bryde de kovalente bindinger i vand (H₂O) og kuldioxid (CO₂) og danne nye kovalente bindinger for at skabe glukose (C₆H₁₂O₆) og ilt (O₂).
Nøglepunkter
* Den type kemiske binding, der er brudt og dannet, bestemmer den type kemiske reaktion og de involverede energiændringer.
* Bond Breaking kræver energiindgang, mens obligationsdannelse frigiver energi.
* Reaktioner kan klassificeres som endotermisk (kræver energi) eller eksoterm (frigørelse af energi) baseret på den samlede energiændring.
Yderligere oplysninger
* obligationsstyrke: Forskellige typer kemiske bindinger har forskellige styrker. Kovalente bindinger er generelt stærkere end ioniske bindinger, og metalliske bindinger er varierende i styrke.
* obligationspolaritet: Polariteten af kovalente bindinger påvirker molekylernes reaktivitet. Polære molekyler har en tendens til at være mere reaktive end ikke -polære molekyler.
Fortæl mig, hvis du gerne vil udforske specifikke reaktioner mere detaljeret eller have andre spørgsmål!
 Varme artikler
Varme artikler
-
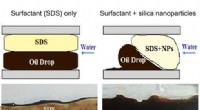 Nye materialer med vigtige anvendelser i forbedret oliegenvindingForskelle i bevægelsen af olie gennem mikrokanalerne ved tilsætning af overfladeaktivt stof i nærvær af silicananopartikler sammenlignet med det overfladeaktive middel alene, hvilket viser, hvordan
Nye materialer med vigtige anvendelser i forbedret oliegenvindingForskelle i bevægelsen af olie gennem mikrokanalerne ved tilsætning af overfladeaktivt stof i nærvær af silicananopartikler sammenlignet med det overfladeaktive middel alene, hvilket viser, hvordan -
 Fremtidige biler kan fremstilles af revolutionerende nyt materialeKredit:CC0 Public Domain Et nyt materiale, der er så stift som metal, men fleksibelt nok til at modstå kraftige vibrationer, kan forvandle bilindustrien, siger eksperter fra University of Surrey.
Fremtidige biler kan fremstilles af revolutionerende nyt materialeKredit:CC0 Public Domain Et nyt materiale, der er så stift som metal, men fleksibelt nok til at modstå kraftige vibrationer, kan forvandle bilindustrien, siger eksperter fra University of Surrey. -
 Ny software bringer cryo-EM-kort i lavere opløsning i fokusEt eksempel på den sekundære strukturdetektering i cryo-EM-densitetskort ved hjælp af Emap2Sec. Til venstre er et EM-kort over archaeal 20S proteasom (EMDB ID:EMD-1733). Til højre er detekteret sekund
Ny software bringer cryo-EM-kort i lavere opløsning i fokusEt eksempel på den sekundære strukturdetektering i cryo-EM-densitetskort ved hjælp af Emap2Sec. Til venstre er et EM-kort over archaeal 20S proteasom (EMDB ID:EMD-1733). Til højre er detekteret sekund -
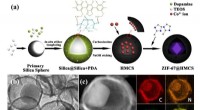 MOF@hule mesoporøse kulstofsfærer som bifunktionelle elektrokatalysatorer(a) Skematisk illustration af syntetisk procedure for ZIF@HMCS. (b) TEM-billede af ZIF@HMCS-25%. (c) HAADF-STEM-billeder og EDS-kortlægninger af ZIF@HMCS-25%. Kredit:©Science China Press Med den h
MOF@hule mesoporøse kulstofsfærer som bifunktionelle elektrokatalysatorer(a) Skematisk illustration af syntetisk procedure for ZIF@HMCS. (b) TEM-billede af ZIF@HMCS-25%. (c) HAADF-STEM-billeder og EDS-kortlægninger af ZIF@HMCS-25%. Kredit:©Science China Press Med den h
- CLOUD-eksperimentforskere viser, at emissioner fra skove påvirker allerførste fase af skydannelse
- Hjælper eller skader genoprettende ret ofre?
- Hvilke moderne organismer synes forskere, at de første celler lignede?
- Solen producerer energi fra stof i sin kerne gennem processen med?
- Usikre ansættelser inden for uddannelse påvirker arbejdere, familier og studerende
- Kan du give et eksempel på et job for hvert område naturvidenskab Livsfysisk og geovidenskab?


