Hvad er mætningstemperaturen på damp eller kogning af en væske?
Her er en sammenbrud:
* damptryk: Hver væske udøver et tryk på grund af dets dampmolekyler, der slipper ud i det omgivende rum. Dette tryk øges, når temperaturen stiger.
* Omgivende pres: Dette er miljøets pres omkring væsken. For eksempel ved havoverfladen er det atmosfæriske tryk ca. 1 atm.
* kogepunkt: Når væskens damptryk når det omgivende tryk, koges væsken. Bobler af damp dannes i væsken og stiger til overfladen.
Vigtige punkter:
* afhængighed af pres: Kogepunktet for en væske er ikke en fast værdi. Det afhænger af det omgivende pres. For eksempel koges vand ved 100 ° C ved standard atmosfærisk tryk (1 atm), men i højere højder, hvor det atmosfæriske tryk er lavere, koges vand ved en lavere temperatur.
* mætning: På kogepunktet siges dampen at være mættet, hvilket betyder, at den holder den maksimale mængden af damp, den kan ved den temperatur og tryk.
Eksempel:
Forestil dig en gryde med vand på en komfur. Når du opvarmer vandet, øges dets damptryk. Når damptrykket når trykket fra den omgivende luft, begynder vandet at koge.
I resuméet er mætningstemperaturen for en damp eller kogepunktet for en væske den temperatur, hvormed damptrykket for væsken er lig med det omgivende tryk.
 Varme artikler
Varme artikler
-
 Forskere hjælper med at udvikle bæredygtige polymererUndersøgelsen af Rufina Alamo og den tidligere doktorand Xiaoshi Zhang blev vist på forsiden af Macromolecules. Alamo og Zhang designede illustrationen, og Zhang tegnede det. Kredit:Xiaoshi Zhang
Forskere hjælper med at udvikle bæredygtige polymererUndersøgelsen af Rufina Alamo og den tidligere doktorand Xiaoshi Zhang blev vist på forsiden af Macromolecules. Alamo og Zhang designede illustrationen, og Zhang tegnede det. Kredit:Xiaoshi Zhang -
 Det biologisk nedbrydelige batteri, der er 3D-printet, engangs og lavet af papirDet biologisk nedbrydelige batteri består af fire lag, alle flyder ud af en 3D-printer efter hinanden. Det hele bliver så foldet sammen som en sandwich, med elektrolytten i midten. Billede:Gian Vaitl
Det biologisk nedbrydelige batteri, der er 3D-printet, engangs og lavet af papirDet biologisk nedbrydelige batteri består af fire lag, alle flyder ud af en 3D-printer efter hinanden. Det hele bliver så foldet sammen som en sandwich, med elektrolytten i midten. Billede:Gian Vaitl -
 Smart svamp kunne rense oliespildSmart svamp absorberer selektivt olie (til venstre), mens den modstår vand (til højre). Kredit:Northwestern University Et team ledet af Northwestern University har udviklet en meget porøs smart sv
Smart svamp kunne rense oliespildSmart svamp absorberer selektivt olie (til venstre), mens den modstår vand (til højre). Kredit:Northwestern University Et team ledet af Northwestern University har udviklet en meget porøs smart sv -
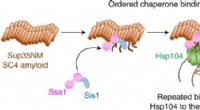 Tre ledsagere koordinerer opdelingen af amyloidfibriller i gærKredit:Yoshiko Nakagawa et al., Nature Chemical Biology (2022). DOI:10.1038/s41589-021-00951-y I et fund, der har vigtige konsekvenser for neurodegenerative lidelser såsom Alzheimers sygdom, har RI
Tre ledsagere koordinerer opdelingen af amyloidfibriller i gærKredit:Yoshiko Nakagawa et al., Nature Chemical Biology (2022). DOI:10.1038/s41589-021-00951-y I et fund, der har vigtige konsekvenser for neurodegenerative lidelser såsom Alzheimers sygdom, har RI


