Tre ledsagere koordinerer opdelingen af amyloidfibriller i gær
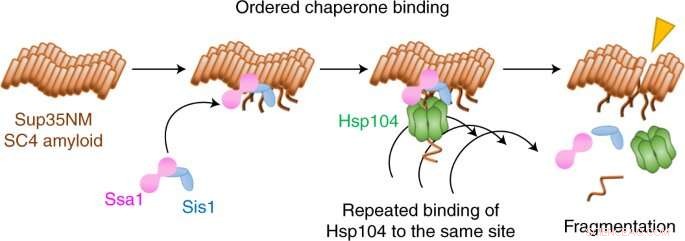
Kredit:Yoshiko Nakagawa et al., Nature Chemical Biology (2022). DOI:10.1038/s41589-021-00951-y
I et fund, der har vigtige konsekvenser for neurodegenerative lidelser såsom Alzheimers sygdom, har RIKEN-forskere opdaget, hvordan tre chaperon-molekyler i gærceller arbejder sammen for at opdele beta-ark-rige fibrillære proteinaggregater kendt som amyloidfibriller.
Proteiner, der er foldet på den forkerte måde, kan ikke udføre deres arbejde ordentligt. Nogle fejlfoldede proteiner, kendt som prioner, er særligt lumske, fordi de overfører deres forvrængede former til proteinerne omkring dem, som derefter væver sig sammen for at danne robuste flåder kaldet amyloidfibriller. Amyloidfibriller er blevet impliceret i prionsygdomme (såsom Creutzfeldt-Jakobs sygdom), som altid er dødelige, og neurodegenerative lidelser såsom Alzheimers og Parkinsons sygdom.
Processen, hvorved amyloidfibriller dannes, har fået meget opmærksomhed, men man ved meget mindre om mekanismen, hvorved de brydes op i celler. Denne adskillelsesproces er vigtig, fordi de fragmenter, den producerer, kan tillade prioner at sprede sig mellem celler.
"Mange forskere har undersøgt dannelsesmekanismen for amyloidfibriller, men der har været meget få undersøgelser af amyloiddisaggregation," siger Motomasa Tanaka fra RIKEN Center for Brain Science. "Men de små proteinfragmenter tjener som frø til dannelse af amyloidfibriller andre steder, og tidligere arbejde fra os tyder på, at amyloiddisaggregation faktisk er vigtigere end amyloidfibrillernes vækst."
At vide, hvordan amyloidfibriller brydes op, kunne også hjælpe forskere med at udvikle behandlinger for prion- og neurodegenerative sygdomme.
Nu har Yoshiko Nakagawa, Tanaka og kolleger brugt en form for enkeltmolekyle fluorescensmikroskopi til at filme, hvordan tre molekyler koordinerer for at bryde amyloidfibriller op i et prionsystem i gær.
De fandt ud af, at bruddet begynder med to chaperoner, Hsp70 og Hsp40, der forbereder jorden ved at binde sig til fibrillen. En tredje chaperone, Hsp104, spåner derefter fibrillen ved gentagne gange at binde sig til det samme sted.
Interessant nok fandt holdet, at ud over denne fragmenteringsmekanisme, bryder en opløsningsmekanisme også fibriller op, men ved en meget anderledes chaperone-koreografi. Hvilken mekanisme der opstår afhænger af fibrillens molekylære form eller bekræftelse.
Der var mange overraskelser i denne undersøgelse, bemærker Tanaka. "Vi forventede ikke, at Hsp104 binder sig til det samme sted så mange gange for at fragmentere amyloidfibriller," siger han. "Og opdelingsmåderne for de to forskellige fibrilbekræftelser er meget forskellige:Fragmenteringsmekanismen producerede mange små fragmenter, hvorimod amyloidfiberfluorescensen gradvist forsvandt for opløsningsmekanismen."
Holdet har til hensigt at udforske mekanismerne mere detaljeret, og i fremtiden håber de at opnå atomopløsning. + Udforsk yderligere
Opklaring af mysterierne omkring type 2-diabetes
 Varme artikler
Varme artikler
-
 Maddikeanalyse går molekylært til retsmedicinske sagerKredit:CC0 Public Domain Maddiker på en død krop eller et sår kan hjælpe med at finde ud af, hvornår en person eller et dyr døde, eller når mishandling begyndte hos ældre, børnepasnings- eller dyr
Maddikeanalyse går molekylært til retsmedicinske sagerKredit:CC0 Public Domain Maddiker på en død krop eller et sår kan hjælpe med at finde ud af, hvornår en person eller et dyr døde, eller når mishandling begyndte hos ældre, børnepasnings- eller dyr -
 Gennembrud i at udnytte kraften fra biologiske katalysatorerForskningen er et skridt i retning af at integrere enzymer i den nuværende kemiske industriinfrastruktur. Kredit:University of Bath Naturens kraft kan snart bruges til at skabe daglige materialer
Gennembrud i at udnytte kraften fra biologiske katalysatorerForskningen er et skridt i retning af at integrere enzymer i den nuværende kemiske industriinfrastruktur. Kredit:University of Bath Naturens kraft kan snart bruges til at skabe daglige materialer -
 Peptider, der kan tages som en pilleStruktur af et dobbeltbro-peptid, der ikke nedbrydes af enzymer i mave og tarme. De to stabiliserende kemikaliebroer er vist med rødt. Kredit:C. Heinis (EPFL) Peptider er korte kæder af aminosyrer
Peptider, der kan tages som en pilleStruktur af et dobbeltbro-peptid, der ikke nedbrydes af enzymer i mave og tarme. De to stabiliserende kemikaliebroer er vist med rødt. Kredit:C. Heinis (EPFL) Peptider er korte kæder af aminosyrer -
 Forskning peger på stærk indvirkning fra vandrensning til lægemiddelproduktionKredit:Pixabay/CC0 Public Domain Vand er underligt - og alligevel så vigtigt. Faktisk, det er et af de mest usædvanlige molekyler på Jorden. Det koger ved en temperatur det ikke burde. Det udvider
Forskning peger på stærk indvirkning fra vandrensning til lægemiddelproduktionKredit:Pixabay/CC0 Public Domain Vand er underligt - og alligevel så vigtigt. Faktisk, det er et af de mest usædvanlige molekyler på Jorden. Det koger ved en temperatur det ikke burde. Det udvider
- Ny blodprøve afslører modtagelighed for dyr sygdom hos malkekøer
- NASA ønsker at skabe det sejeste sted i universet
- Slip sukkeret! En værdifuld byggesten til fremstilling af produkter af madaffald
- Ny maskinlæringsteori rejser spørgsmål om videnskabens natur
- Suomi NPP-satellit får nat og infrarød udsigt over orkanen Hector
- Opskriften er anderledes, men Saturns måne Titan har ingredienser til livet


