Beregn det udførte arbejde, når 1,0 mol vand ved 273 K fordamper mod som atmosfærisk tryk atmosfære. Antag ideel gasadfærd.?
forståelse af koncepterne
* fordampning: Dette er processen med en væske, der skifter til en gas.
* arbejde udført: I termodynamik er arbejde udført af et system den energi, der overføres af systemet på grund af en ændring i volumen. For en ideel gas beregnes dette som:
* W =-pΔv (hvor p er tryk og ΔV er ændringen i volumen)
* Ideel gaslov: PV =NRT (hvor P er tryk, V er volumen, N er mol, R er den ideelle gaskonstant, og T er temperatur)
Beregninger
1. Bestem det oprindelige bind:
* Da vand er en væske, kan vi ignorere dets oprindelige volumen.
2. Bestem det endelige volumen (volumen af vanddamp):
* Brug den ideelle gaslov til at finde volumenet på 1 mol vanddamp ved 273 K og 1 ATM -tryk.
* V =(NRT)/P =(1 mol * 0,0821 L · ATM/Mol · K * 273 K)/1 ATM ≈ 22,4 L
3. Beregn ændringen i volumen:
* ΔV =slutvolumen - oprindeligt volumen ≈ 22,4 l - 0 l =22,4 L
4. Beregn arbejde udført:
* W =-pδv =-(1 atm) * (22,4 l) ≈ -22,4 l · atm
Konvertering til Joules
* 1 l · atm =101.325 J
* Derfor W ≈ -22,4 L · ATM * 101.325 J/L · ATM ≈ -2270 J
Vigtig note: Denne beregning antager, at fordampningsprocessen forekommer ved konstant tryk (isobarisk).
Konklusion
Arbejdet, der udføres, når 1 mol vanddampning mod atmosfærisk tryk ved 273 K er ca. -2270 J. Det negative tegn indikerer, at arbejdet udføres * af * systemet (vanddampen) på omgivelserne (atmosfæren).
Sidste artikelEr sukker omrørt i te en blanding eller forbindelse?
Næste artikelWho disproved the Rutherford model of atom?
 Varme artikler
Varme artikler
-
 Bæredygtige sprøjtebetonblandingsdesign til tunneler med længere levetidAnvendelsen af sprøjtebeton er en af de vigtigste støtteforanstaltninger i tunnelbyggeriet. Kredit:ASSpC - TU Graz Levetiden for tunneler i dag er designet til at holde i mindst hundrede år -
Bæredygtige sprøjtebetonblandingsdesign til tunneler med længere levetidAnvendelsen af sprøjtebeton er en af de vigtigste støtteforanstaltninger i tunnelbyggeriet. Kredit:ASSpC - TU Graz Levetiden for tunneler i dag er designet til at holde i mindst hundrede år - -
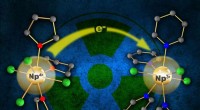 Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces
Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces -
 Puster nyt liv i farvesensibiliserede solcellerEt nyt molekylært farvestof forbedrer effektiviteten af solceller. Kredit:Izumi Mindy Takamiya Forskere ved Institute for Integrated Cell-Material Sciences ved Kyoto University har gjort en popu
Puster nyt liv i farvesensibiliserede solcellerEt nyt molekylært farvestof forbedrer effektiviteten af solceller. Kredit:Izumi Mindy Takamiya Forskere ved Institute for Integrated Cell-Material Sciences ved Kyoto University har gjort en popu -
 Disse mikrober spiser elektroner til energiFotoferrotrofe organismer bruger lys og elektroner fra miljøet som energikilde. Kredit:Duke Research Blog Den menneskelige krop er befolket af et større antal mikrober end dens egne celler. Disse
Disse mikrober spiser elektroner til energiFotoferrotrofe organismer bruger lys og elektroner fra miljøet som energikilde. Kredit:Duke Research Blog Den menneskelige krop er befolket af et større antal mikrober end dens egne celler. Disse
- San Antonio-forskere søger at forhindre luft- og rumfartsfejl og katastrofer med olieudslip
- Fejludsatte kvantebits kunne rette sig selv, fysikere viser
- Triassurus sixtelae fossil fundet i Kirgisistan er den ældste salamander, der nogensinde er fundet
- Musikhitlister bliver i stigende grad kortvarige
- Biologer lærte, hvad Przewalskis hest spiste for mere end et århundrede siden
- Hvorfor er brændstoffer nyttige for os?


