CRO42-ionet var involveret i en kemisk reaktion, hvor den omdannede til CR3 plus ioner. Hvad er ændringsoxidationsantallet af kromatom?
1. Bestem det indledende oxidationsnumre krom i cro₄²⁻:
* Oxygen har typisk et oxidationsnummer på -2.
* Den samlede ladning af kromationen (cro₄²⁻) er -2.
* Lad X være oxidationsantallet af krom.
* Brug af formlen:x + 4 (-2) =-2
* Løsning for X, får vi X =+6.
2. Bestem det endelige oxidationsnummer på krom i cr³⁺:
* Oxidationsnummeret for en monatomisk ion er lig med dens ladning.
* Derfor er oxidationsantallet af krom i cr³⁺ +3.
3. Beregn ændringen i oxidationsnummer:
* Ændring i oxidationsnummer =endelig oxidationsnummer - indledende oxidationsnummer
* Ændring i oxidationsnummer =+3 - +6 =-3
Derfor er ændringen i oxidationsnummeret for kromatomet -3. Dette betyder, at kromatomet fik 3 elektroner under reaktionen.
Sidste artikelHvad er en forbindelse i periodisk tabel?
Næste artikelHvilke varer har et pH -niveau mellem 5 og 8?
 Varme artikler
Varme artikler
-
 Forskere laver ny opskrift på kringleformede peptiderDr. Christoph Nitsche. Kredit:Australian National University Forskere fra The Australian National University (ANU) har udviklet en ny måde at syntetisere bicykliske peptider på, med store konsekven
Forskere laver ny opskrift på kringleformede peptiderDr. Christoph Nitsche. Kredit:Australian National University Forskere fra The Australian National University (ANU) har udviklet en ny måde at syntetisere bicykliske peptider på, med store konsekven -
 Klud ansigtsmasker, der kan desinficeres af sollysKredit:Unsplash/CC0 Public Domain Under COVID-19-pandemien, mange mennesker har vænnet sig til at bære ansigtsmasker af bomuld på offentlige steder. Imidlertid, vira og bakterier, der klæber til m
Klud ansigtsmasker, der kan desinficeres af sollysKredit:Unsplash/CC0 Public Domain Under COVID-19-pandemien, mange mennesker har vænnet sig til at bære ansigtsmasker af bomuld på offentlige steder. Imidlertid, vira og bakterier, der klæber til m -
 Bæredygtig nylonproduktion muliggjort ved opdagelse af bakterierArbejde med adipinsyrebakterier i Wallace Lab, University of Edinburgh. Kredit:The Wallace Lab, University of Edinburgh Nylonfremstilling kan revolutioneres ved opdagelsen af, at bakterier kan gør
Bæredygtig nylonproduktion muliggjort ved opdagelse af bakterierArbejde med adipinsyrebakterier i Wallace Lab, University of Edinburgh. Kredit:The Wallace Lab, University of Edinburgh Nylonfremstilling kan revolutioneres ved opdagelsen af, at bakterier kan gør -
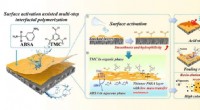 Nye syrefaste membraner til spildevandsrensning udvikletSkematisk mekanisme til fremstilling af syrefast nanofiltreringsmembran og dens overlegne separationsydelse. Kredit:CAO Yang En forskergruppe ledet af prof. Wan Yinhua fra Institute of Process Eng
Nye syrefaste membraner til spildevandsrensning udvikletSkematisk mekanisme til fremstilling af syrefast nanofiltreringsmembran og dens overlegne separationsydelse. Kredit:CAO Yang En forskergruppe ledet af prof. Wan Yinhua fra Institute of Process Eng
- Sådan ser bier:Små knopper på blomsterbladene skaber intens farve og tiltrækker bestøvere
- Matematiske beregninger viser, at kvantekommunikation på tværs af det interstellare rum burde vær…
- Bedre forståelse af cellulær metabolisme ved hjælp af AI
- Dødstal efter filippinsk storm, jordskred stiger til 126
- Sammenbrud af den europæiske indlandsis forårsagede kaos
- Hvorfor har du brug for signalfaser i rummet?


