Bedre forståelse af cellulær metabolisme ved hjælp af AI
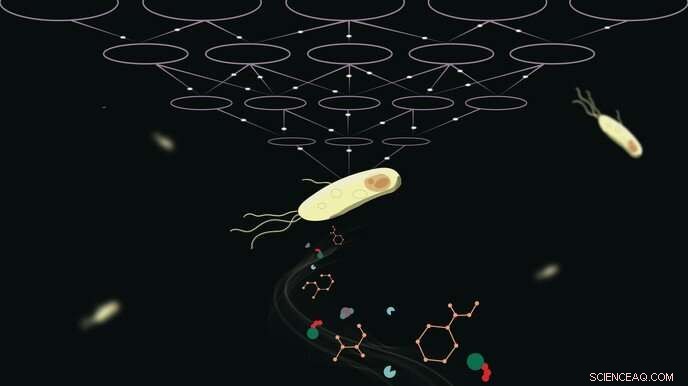
Kredit:Subham Choudhury
Metabolisme er afgørende for alle levende organismer, og modellering af de kemiske reaktioner, der opretholder livet, er ingen let opgave. Nu har EPFL-forskere frigivet REKINDLE, en dyb læringsproces, der baner vejen for mere effektiv og præcis modellering af metaboliske processer.
Den måde en organisme omsætter næringsstoffer på er en kompleks proces. I litteraturen kan processen modelleres ved hjælp af et sæt matematiske ligninger med parametre, der er specifikke for hver organisme.
De parametre, man ville måle for et menneske, ville være forskellige fra dem for en mus, bakterier, gær eller en hvilken som helst levende organisme. Hvis vi havde adgang til disse parametre for en given levende organisme, så ville dens tilsvarende model være komplet, den ville matche observation fra den virkelige verden, og in silico undersøgelser ville være mulige for bedre design af in vitro og in vivo undersøgelser.
På et praktisk niveau er det imidlertid en kompliceret sag at bestemme disse parametre på grund af manglen på eksperimentelle data. Typisk kræver forskere store mængder eksperimentelle data og beregningsressourcer for at bestemme disse parametre. Men hvad nu hvis man kunne omgå behovet for omfattende data og stadig producere en model, der svarer til eksperimentel observation og måling? EPFL-forskere foreslår netop det med REKINDLE, en dyb læringsbaseret beregningsramme, der reproducerer de dynamiske metaboliske egenskaber observeret i celler. Resultaterne er offentliggjort i Nature Machine Intelligence .
"REKINDLE vil gøre det muligt for forskersamfundet at reducere beregningsmæssige bestræbelser på at generere kinetiske modeller med flere størrelsesordener. Det vil også hjælpe med at postulere nye hypoteser ved at integrere biokemiske data i disse modeller, belyse eksperimentelle observationer og styre nye terapeutiske opdagelser og bioteknologiske designs, " siger Ljubisa Miskovic fra EPFL's Laboratory of Computational Systems Biotechnology og co-PI i undersøgelsen.
"Det overordnede formål med metabolisk modellering er at beskrive den cellulære metaboliske adfærd i en sådan grad, at forståelse og forudsigelse af virkningerne af variationer i cellulære tilstande og miljøforhold pålideligt kan testes for en bred vifte af undersøgelser inden for sundhed, bioteknologi og systemer og systemer. syntetisk biologi," forklarer Subham Choudhury, førsteforfatter af undersøgelsen. "Vi håber, at REKINDLE letter opbygningen af metaboliske modeller for det bredere samfund."
Metoden har direkte bioteknologiske anvendelser, da kinetiske modeller er vigtige værktøjer til forskellige undersøgelser, herunder bioproduktion, lægemiddelmålretning, mikrobiom-interaktioner og bioremediering.
EPFL-forskerne er særligt interesserede i, hvordan REKINDLE kan bruges til at optimere det metaboliske netværk af mikrober til at producere kemiske forbindelser i industriel skala, f.eks. ved at erstatte den traditionelle petrokemiske baserede industri med cellebaserede fabrikker.
En stor udfordring, der forhindrer den udbredte brug af kinetisk modellering i forskningssamfundet, er de omfattende beregningskrav og manglen på standardiseret beregningssoftware. EPFL-forskerne håber, at deres dyb-læringsbaserede rammer vil forene indsatsen i det videnskabelige samfund.
"REKINDLE bruger standard, udbredte Python-biblioteker, der gør det tilgængeligt og nemt at bruge," fortsætter Choudhury. "Vores hovedmål med denne undersøgelse er at bane vejen for at gøre denne form for modelleringsindsats open source og tilgængelig, så alle i de syntetiske og systembiologiske samfund kan bruge dem til deres eget forskningsmål, hvad end de måtte være." + Udforsk yderligere
AI som et 'klogt råd' for syntetisk biologi
Sidste artikelImmunfunktion ombygget af mitokondriel form
Næste artikelSe antibiotika i aktion inde i en patogen bakterie
 Varme artikler
Varme artikler
-
 Videnskabsprojekter: Rygning og dens virkninger på lungerneRygning har en række alvorlige syge effekter på helbredet. Selvom rygning påvirker både luftvejssystemet og det kardiovaskulære system, kan studerende gennemføre en række videnskabelige projekter for
Videnskabsprojekter: Rygning og dens virkninger på lungerneRygning har en række alvorlige syge effekter på helbredet. Selvom rygning påvirker både luftvejssystemet og det kardiovaskulære system, kan studerende gennemføre en række videnskabelige projekter for -
 Epigenetisk kontrol af transkriptionel stabilitet opretholder identitet og funktion i dopaminerge og…Reducerede niveauer af TH i mellemhjernens dopaminerge neuroner hos mus, hvor PRC2 er blevet inaktiveret. Kredit:Karolinska Institutet En ny undersøgelse fra forskere ved Karolinska Institutet offe
Epigenetisk kontrol af transkriptionel stabilitet opretholder identitet og funktion i dopaminerge og…Reducerede niveauer af TH i mellemhjernens dopaminerge neuroner hos mus, hvor PRC2 er blevet inaktiveret. Kredit:Karolinska Institutet En ny undersøgelse fra forskere ved Karolinska Institutet offe -
 Hvorfor husker vi smerter?Vi danner minder om smerter for ikke at gentage en farlig adfærd. Imidlertid, kroniske smerter kan være vedvarende smertehukommelser i nervesystemet. © iStockphoto.com/MotoEd I 1954, to forskere ved
Hvorfor husker vi smerter?Vi danner minder om smerter for ikke at gentage en farlig adfærd. Imidlertid, kroniske smerter kan være vedvarende smertehukommelser i nervesystemet. © iStockphoto.com/MotoEd I 1954, to forskere ved -
 Lynnedslag former tropiske skoveJeannine Richards, en post-doc forsker i botanik, elskede at se tordenvejr som barn. Nu er hun begejstret for at fortsætte med at studere dens effekt på tropiske træer. Kredit:Jeannine Richards Det
Lynnedslag former tropiske skoveJeannine Richards, en post-doc forsker i botanik, elskede at se tordenvejr som barn. Nu er hun begejstret for at fortsætte med at studere dens effekt på tropiske træer. Kredit:Jeannine Richards Det
- Hvordan bruges solenergi?
- Hurtigt tilberedte nanomaterialer i mikrobølgeovn for at lave morgendagens klimaanlæg
- BESSY II:Ultrahurtig skift af helicitet af cirkulært polariserede lysimpulser
- Forsker diskuterer at reducere energiforbruget i aluminiumforarbejdning med 40 %
- Hvordan et par negative onlineanmeldelser tidligt kan skade en restaurant
- Maleri fra Haystacks-serien sætter auktionsrekord for Monet


