Se antibiotika i aktion inde i en patogen bakterie
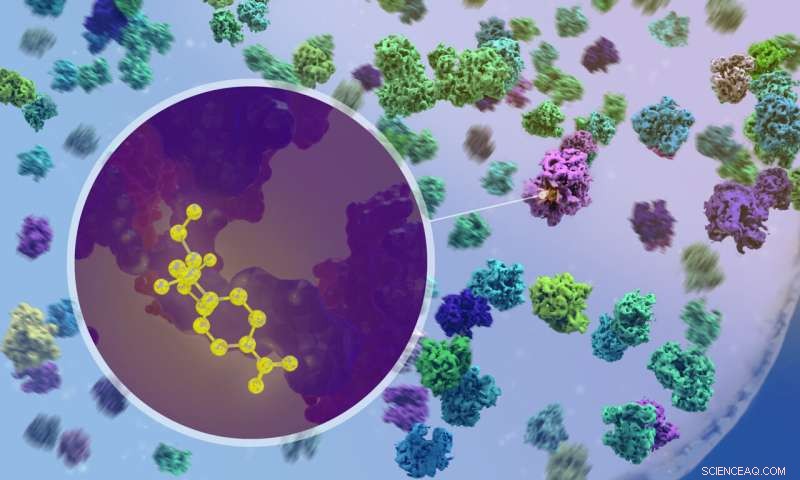
Forskere brugte kryo-elektrontomografi til at visualisere, hvordan antibiotika binder sig til ribosomer inde i bakterier. Kredit:Isabel Romero Calvo/EMBL
Hver levende celle er afhængig af proteiner for at fungere, og processen med proteinsyntese - oversættelse - er afgørende for overlevelse. Bakterier er ingen undtagelse, hvor molekylære maskiner involveret i translation er et af de mest almindelige mål for antibiotika.
Nu, for første gang, har forskere ledet af Julia Mahamids gruppe ved EMBL Heidelberg visualiseret i atomare detaljer, hvordan antibiotika påvirker processen med proteinproduktion inde i bakterieceller. Denne undersøgelse, offentliggjort i Nature, markerer også første gang, hvor videnskabsmænd har observeret strukturelle ændringer på atomniveau i det aktive oversættelsesmaskineri direkte inde i en celle i stedet for at bruge isolerede molekyler i et reagensglas. Det er vigtigt, at denne tilgang tillod dem at identificere mekanismer, som sådanne maskiner bruger til at "tale" med hinanden inde i celler.
Undersøgelsen er udført i samarbejde med forskere fra Max-Planck-Institute for Biophysical Chemistry, Göttingen, Wellcome Center for Cell Biology, University of Edinburgh og Technische Universität Berlin. Forskningen involverede også bidrag fra Zimmermann-Kogadeeva- og Bork-grupperne ved EMBL Heidelberg, som hjalp forskerne med at udføre bioinformatiske analyser for at observere, hvordan diversiteten i ribosomale proteiner ser ud på tværs af>4000 repræsentative bakterier.
Minuskulære bakterier og molekylære maskiner
Mahamid og hendes team er eksperter i at studere bakterien Mycoplasma pneumoniae ved hjælp af en teknik kaldet kryo-elektrontomografi (cryo-ET). Denne lille bakterie, som forårsager atypisk lungebetændelse hos mennesker, har et fuldt funktionelt proteinsyntesemaskineri, på trods af at den kun er omkring ti tusindedel af en millimeter i størrelse.
"Vi valgte Mycoplasma til vores undersøgelser, fordi de er blandt de mindste og mest minimale levende celler og er blevet brugt i vid udstrækning som modelceller i systembiologiske og syntetiske biologistudier," siger Liang Xue, postdoc i Mahamid-gruppen og førsteforfatter af undersøgelsen.
Cryo-ET giver forskere mulighed for at tage serielle billeder af flash-frosne biologiske prøver ved hjælp af et elektronmikroskop og kombinere de resulterende billeder for at danne et tredimensionelt billede af en celle - lidt ligesom en mini-MRI-maskine. "Med cryo-ET-data i stor skala fra uberørte bevarede celler er det muligt at fange snapshots i høj opløsning af forskellige tilstande af en molekylær maskine i aktion og kombinere dem til en film," sagde Mahamid.
En af de mest fremtrædende strukturer, når man ser på et kryo-ET-billede af en Mycoplasma-celle, er små mørke klatter - disse er ribosomerne. "Ribosomet er en af de ældste makromolekylære maskiner, som kan have eksisteret selv før fremkomsten af celler," sagde Xue. Ribosomer er de primære molekylære maskiner, der er involveret i proteinoversættelse, og de er til stede i alle celler - fra bakterier til mennesker.
Mahamid-gruppens tilgang tillod dem ikke kun at se og tælle ribosomerne inde i bakterierne, men også se deres struktur ved atomopløsning. Ved at studere et stort antal ribosomer "frosset" på forskellige stadier af deres aktivitetscyklus, kunne forskerne tyde, hvordan ribosomstrukturen ændrer sig, mens den fortsætter gennem proteinsynteseprocessen. Ikke kun dette, men de kunne også lokalisere ribosomerne i det tredimensionelle rum inde i cellen, hvilket gjorde det muligt for dem at identificere, hvordan processen med translation er organiseret rumligt.
"Inde i levende celler fungerer ribosomer som stærkt forbundne systemer snarere end individuelle molekylære maskiner," sagde Xue. "Vi afslørede nye funktioner i ribosomer og de forskellige translationsreaktionsveje i celler."
Antibiotika i aktion
Det er afgørende, at forskerne ved hjælp af cryo-ET kunne observere, hvad der sker, når antibiotika kommer ind i cellen og binder sig til ribosomer. For eksempel kunne de bekræfte, at de to bredspektrede antibiotika chloramphenicol og spectinomycin binder til forskellige steder på ribosomet og forstyrrer forskellige trin i proteinsynteseprocessen. Dette var blevet forudsagt af undersøgelser af isolerede ribosomer, men aldrig før blevet observeret i aktion inde i en egentlig bakteriecelle.
"Det var meget spændende, da vi første gang var i stand til at se lægemiddelmolekylet binde sig til et ribosom inde i cellen," sagde Xue. "Men det var endnu mere spændende, da vi fandt ud af, at ribosompopulationerne i antibiotika-behandlede celler er fundamentalt omformet - funktionelt, strukturelt og rumligt."
Forskerne observerede, at interaktionerne mellem ribosomer og andre komplekser i cellen ændrede sig som reaktion på lægemidlet, hvilket tyder på, at et antibiotikum kan have en effekt, der rækker langt ud over det specifikke kompleks, det binder sig til. "På den ene side kan dette hjælpe med at forstå effekten af antibiotika uden for målet, og det kan også hjælpe med at designe kombinationer af antibiotika for at øge deres effektivitet," sagde Mahamid.
Mahamid-gruppen fortsætter med at bruge kryo-ETs kraft til at studere fundamentale biologiske processer. "Det, vi er i stand til at gøre for dette udsøgt enkle modelsystem, er i princippet gældende for meget mere komplekse modeller," sagde Mahamid. "For eksempel studerer vi i vores gruppe interaktionen mellem vira og deres humane cellevært, organiseringen af menneskelige pluripotente stamceller og funktionen af deres ribosomer og endda store multicellulære 3D-organoider, som vores samarbejdspartnere og vi dyrker fra celler taget direkte fra kræftpatienter." + Udforsk yderligere
Forskere identificerer bakterielt protein, der registrerer og redder 'stoppede' ribosomer
 Varme artikler
Varme artikler
-
 Iran flytter for at redde sidste maskot asiatiske geparderEn fanget kvindelig asiatisk gepard ved navn Dalbar går i en indhegning i Pardisan Park i Teheran Iranske miljøforkæmpere har mobiliseret for at beskytte verdens sidste asiatiske geparder, anslås
Iran flytter for at redde sidste maskot asiatiske geparderEn fanget kvindelig asiatisk gepard ved navn Dalbar går i en indhegning i Pardisan Park i Teheran Iranske miljøforkæmpere har mobiliseret for at beskytte verdens sidste asiatiske geparder, anslås -
 Deler menneskelige embryoner og kræft den samme startsikring?Illustration af påbegyndelsen af embryonalt liv umiddelbart efter befrugtning. Starter skiftet, der begynder embryodannelse, også kræft? Kredit:Dr. Maki Asami/University of Bath I befrugtningsøje
Deler menneskelige embryoner og kræft den samme startsikring?Illustration af påbegyndelsen af embryonalt liv umiddelbart efter befrugtning. Starter skiftet, der begynder embryodannelse, også kræft? Kredit:Dr. Maki Asami/University of Bath I befrugtningsøje -
 Forskere identificerer en måde at svække malariaparasitter mod populær lægemiddelbehandlingKredit:CDC Indiana University School of Medicine -forskere har identificeret en måde at blokere parasiternes evne, der får malaria til at beskytte sig mod lægemiddelbehandlinger hos inficerede mus
Forskere identificerer en måde at svække malariaparasitter mod populær lægemiddelbehandlingKredit:CDC Indiana University School of Medicine -forskere har identificeret en måde at blokere parasiternes evne, der får malaria til at beskytte sig mod lægemiddelbehandlinger hos inficerede mus -
 Hvordan man holder køer gladeKredit:CC0 Public Domain Indhegninger bruges på husdyrbrug rundt om i verden til at samle dyrene, når de skal vejes eller vaccineres. Ny forskning viser nu, at fjernelse af stænk af farver, skygge
Hvordan man holder køer gladeKredit:CC0 Public Domain Indhegninger bruges på husdyrbrug rundt om i verden til at samle dyrene, når de skal vejes eller vaccineres. Ny forskning viser nu, at fjernelse af stænk af farver, skygge
- NASA ser Tropical Storm Man-yi nærme sig tyfonstyrke Tropical Storm Man-Yi con
- Ultratynde guld nanoribbons med unik sekskantet krystalfase viser væskelignende adfærd
- Undersøgelse bekræfter indflydelsen af planetariske tidevandskræfter på solaktivitet
- Fortvivlelse som lammende tørke hamrer australske landmænd
- Arkæologer afslører menneskelig modstandskraft over for klimaændringer i det gamle Tyrkiet


