Lyver kvalitetssikring af nye stamceller:Makrofager foretager undersøgelsen
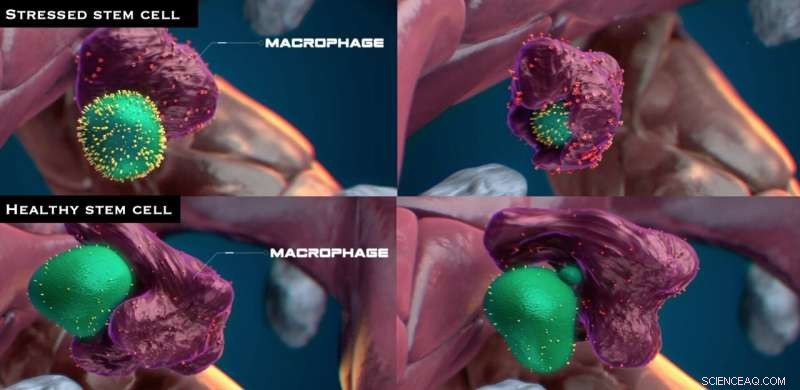
De to øverste paneler viser en stresset stamcelle, som angivet ved, at calreticulinet udtrykt på dens overflade (gule pigge), bliver opslugt og spist af en makrofag. De to nederste paneler viser en sund stamcelle, der udtrykker meget lidt calreticulin, som bliver kontaktet af en makrofag, men ikke spist. I stedet ser makrofagen ud til at trække noget materiale ud fra cellen. Calreticulin fungerer som et "spis mig"-signal. Kredit:Nymus 3D (nymus3d.nl/)
Ved hjælp af levende billeddannelse og cellulær stregkodning har forskere i stamcelleprogrammet på Boston Children's Hospital fået et glimt af, hvordan nye stamceller - i dette tilfælde blodstamceller - undersøges for kvalitet kort efter, de er født. Undersøgelsen, som kan have konsekvenser for cancer og regenerativ medicin, blev offentliggjort den 22. september i tidsskriftet Science .
Ledet af Sam Wattrus, en ph.d. kandidat i laboratoriet hos Leonard Zon, MD, brugte forskerne en zebrafiskmodel til at observere stamcelleudvikling. Når en stamcelle bliver født, fandt de ud af, at den rejser til et særligt sted, hvor immunceller kendt som makrofager kommer i intim fysisk kontakt med hver celle.
Det er, når kontrollen finder sted:Celler, der viser tegn på stress (med høje niveauer af giftige molekyler kendt som reaktive oxygenarter) blev opslugt og spist af makrofagerne, fandt holdet. I modsætning hertil fik tilsyneladende sunde stamceller lov til at leve og blev selektivt amplificeret.
"Når en makrofag interagerer med celler, tager den en enorm mængde biologisk information," siger Wattrus. "Det, vi ser, er, at celler, der har høj stress, elimineres, og dem med lav stress deler sig selektivt."
Ved at udforske yderligere viste Wattrus og kolleger, at de stressede stamceller bar en specifik markør på deres overflade, et protein kendt som calreticulin, der fungerer som et "spis mig"-signal. Stamceller, der manglede calreticulin, eller kun havde små mængder af det, blev ikke spist og så ud til at blive tilskyndet til at udvide sig. Makrofagerne så ud til at fjerne noget materiale fra dem, og stamcellerne fortsatte med at formere sig efter mødet.
"Ved at bruge cellulær stregkodning kan vi måle antallet af kloner (særskilte cellepopulationer) efter interaktionen sker," uddyber Zon, som også er tilknyttet afdelingen for hæmatologi/onkologi og er en Howard Hughes Medical Institute Investigator. "Hvis en makrofag ikke kan lide en stamcelle, vil den klon ikke bidrage til stamcellepuljen."
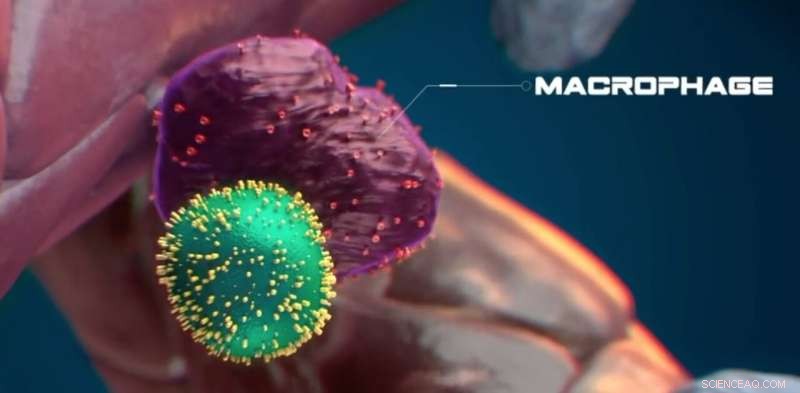
Stamcellen har en overflod af calreticulin (i gult) på overfladen, hvilket indikerer, at den er stresset. Kredit:Nymus 3D (nymus3d.nl/)
Potentielle implikationer for kræft, regenerativ medicin
Holdet observerede også lignende makrofag-stamcelle-interaktioner i embryonale mus. Zon mener, at denne QA-proces kan føre til nye tilgange til kræft og regenerativ medicin, og han forfølger i øjeblikket begge muligheder i sit laboratorium.
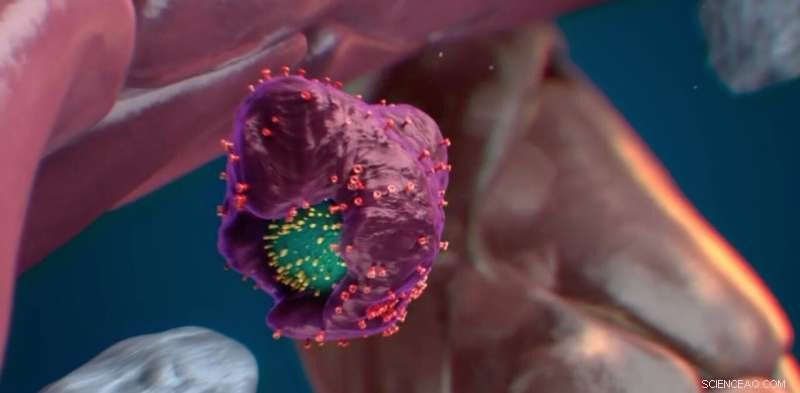
Calreticulin (gule pigge) i stamcellens overflade fungerer som et "spis mig"-signal. Kredit:Nymus 3D (nymus3d.nl/)
"Du ville grundlæggende lære stamcellerne at være attraktive eller frastødende for makrofager med små molekyler eller andre målrettede terapier," siger han.
Det er kendt i kræftverdenen, at kræftceller kan spire "spiser mig ikke"-signaler for at undgå angreb fra vores immunsystem, og der er stor interesse i at blokere disse signaler med antistoffer for at overliste kræften. Men Zon er mere interesseret i "spis mig"-signalerne, og om de kan introduceres i præcancerceller eller kræftceller for at tilskynde makrofager til at ødelægge dem.
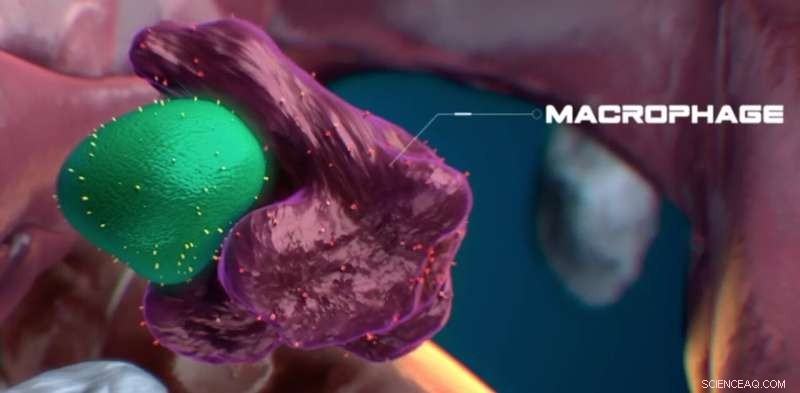
En makrofag kommer i tæt fysisk kontakt og ser ud til at vurdere en stamcelle, der virker sund, med lidt calreticulin på overfladen. Kredit:Nymus 3D (nymus3d.nl/)
Sådanne tilgange kunne potentielt bruges i præ-cancerøse tilstande som klonal hæmatopoiese og myelodysplasi, præget af slyngelstater af blodstamceller, eller ved leukæmi og andre blodkræftformer.
"Der kan være en måde at bruge et lille molekyle til at stresse cellen, hvilket fører til overfladecalreticulin, der får de fornærmende kloner til at blive spist," spekulerer Zon.
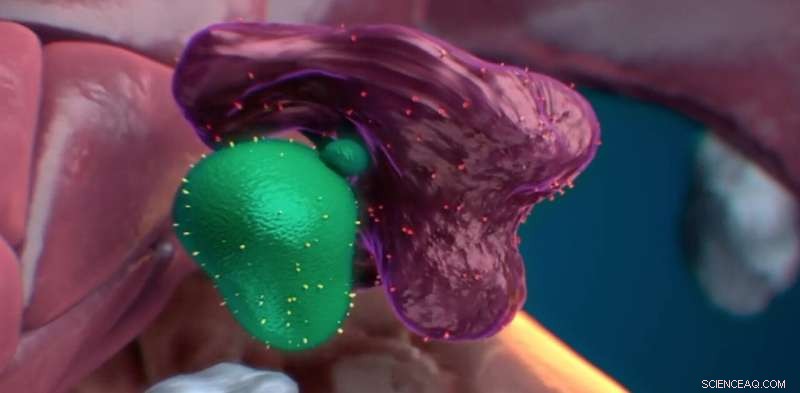
Efter at have kontaktet en tilsyneladende sund stamcelle, ser makrofagen ud til at fjerne noget materiale fra den. Stamcellen fortsætter derefter med at formere sig efter mødet. Kredit:Nymus 3D (nymus3d.nl/)
Han forestiller sig den modsatte tilgang i vævsregenerering, hvor stamcellemarkører kunne manipuleres for at tilskynde makrofager til at optimere stamcellepuljen til cellebaserede terapier. Selvom denne undersøgelse var fokuseret på blodstamceller, mener Zon, at det er sandsynligt, at andre stamcellepopulationer er udsat for en lignende QA-proces.
Hvis det er tilfældet, kan der være store potentielle konsekvenser for livslang sundhed. "Din stamcellepulje er for det meste lavet under embryonal udvikling," bemærker Zon. "Interaktioner, der sker her, bestemmer, hvilke stamceller der skal bruges i voksenalderen." + Udforsk yderligere
Undersøgelse viser, at ACKR1 ikke udtrykkes på monocytter og makrofager på trods af tidligere konklusioner
 Varme artikler
Varme artikler
-
 Er computeren en god model for hjernen?Hjerner deler nogle kvaliteter med computere, men de to er ikke helt analoge. Se flere hjernebilleder. Hemera/Thinkstock Computere gør mange ting meget godt. De kan udføre komplekse beregninger, og d
Er computeren en god model for hjernen?Hjerner deler nogle kvaliteter med computere, men de to er ikke helt analoge. Se flere hjernebilleder. Hemera/Thinkstock Computere gør mange ting meget godt. De kan udføre komplekse beregninger, og d -
 Great Salt Lake på vej til hyper-salinitet, afspejler den iranske sø, viser ny forskningDen Store Saltsø bliver mere salt og skaber en alvorlig trussel mod økosystemerne og de økonomier, der er afhængige af den. Ny forskning fra Wayne Wurtsbaugh undersøger den bane, de to halvdele af søe
Great Salt Lake på vej til hyper-salinitet, afspejler den iranske sø, viser ny forskningDen Store Saltsø bliver mere salt og skaber en alvorlig trussel mod økosystemerne og de økonomier, der er afhængige af den. Ny forskning fra Wayne Wurtsbaugh undersøger den bane, de to halvdele af søe -
 Forskelle i han- og kvindekromosomerDe vigtigste forskelle mellem mænd og kvinder er X- og Y-kromosomerne. Blandt mennesker fremstiller to X-kromosomer en kvinde, og en X- og Y-kromosom udgør en mand. Der er imidlertid andre differentie
Forskelle i han- og kvindekromosomerDe vigtigste forskelle mellem mænd og kvinder er X- og Y-kromosomerne. Blandt mennesker fremstiller to X-kromosomer en kvinde, og en X- og Y-kromosom udgør en mand. Der er imidlertid andre differentie -
 Myrer ofrer deres kolonikammerater som dele af en dødelig desinfektionKredit:Royal Holloway, University of London Ny forskning fra IST Austria (Institute of Science and Technology Austria), i samarbejde med Royal Holloway, University of London, og universitetet i Wü
Myrer ofrer deres kolonikammerater som dele af en dødelig desinfektionKredit:Royal Holloway, University of London Ny forskning fra IST Austria (Institute of Science and Technology Austria), i samarbejde med Royal Holloway, University of London, og universitetet i Wü
- Livscyklus af Harpsæler
- Familiepleje, hjemløshed er hindringer for videregående uddannelse
- Forskere afslører dynamisk sølvkrystallisering ved in-situ SEM
- I en omfattende ny test, EmDrive'et formår ikke at generere nogen fremdrift
- Nedbørsekstremer i tørre områder i Kina fundet tæt forbundet med SST
- Frekvensmodulation fremskynder forskningen i kvanteteknologier


