Immunfunktion ombygget af mitokondriel form
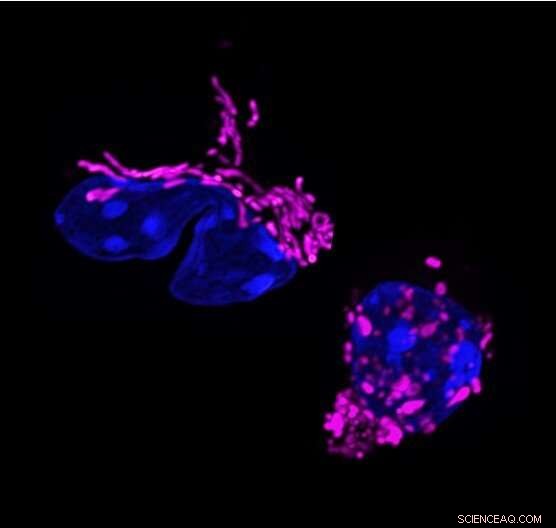
Mitokondriel formændring i T-celleresponsen. Dynamiske ændringer i mitokondriel form knytter sig til T-cellefunktionen. T-hjælper 17-celler viser aflange mitokondrier (farvet i lilla, venstre). Elimination af det mitokondrielle membranformende protein OPA1, fragmenterer mitokondrier i T-celler (til højre) og ændrer T-cellerespons. Kredit:Francesc Baixauli
En ny undersøgelse med fokus på immunsystemets Th17-celler tyder på, at formen og funktionen af deres mitokondrier er vigtig ved autoimmune og inflammatoriske lidelser, såsom dissemineret sklerose. T helper 17 (Th17)-celler er en type CD4+ T-immuncelle, som tilsammen hjælper med at danne antistoffer, aktivere fjende-ædende celler og rekruttere flere soldater til kampfronten.
Forskningen, ledet af Erika Pearce, Ph.D., ved Bloomberg~Kimmel Institute for Cancer Immunotherapy ved Johns Hopkins Kimmel Cancer Center, tyder på, at det at lære, hvordan mitokondrier påvirker Th17-celler, er nøglen til at forstå, hvordan man kontrollerer dem.
Undersøgelsen blev offentliggjort 28. september i tidsskriftet Nature , identificerer flere muligheder for at forsøge at påvirke disse vigtige cellers adfærd med det mål at dæmpe deres autoimmune aktivitet.
Når en T-celle første gang udsættes for en fjende, reagerer den på signaler fra fjenden og miljøet for at blive en af flere typer af specialiserede T-celler, hver bevæbnet med forskellige funktioner i immunresponset. Mens alle undertyper af T-hjælpeceller er afgørende for kroppens kamp mod udlændinge, kan deres ubalance også forårsage sygdom, herunder type 1-diabetes, astma, allergier og kronisk inflammation.
"Hvis vi kunne kontrollere T-celler, kunne vi uden tvivl kontrollere mange, hvis ikke de fleste, infektioner, autoimmuniteter og kræftformer," siger Pearce, studiets seniorforfatter og en anerkendt professor ved Johns Hopkins Bloomberg ved Onkologisk Institut og Institut for Biokemi. Molekylærbiologi.
Undersøgelsen begyndte, da forskere i Pearces laboratorium, som dengang var på Max Planck-instituttet i Freiburg, Tyskland, bemærkede en egenskab, der er ejendommelig for Th17-celler. Blandt tre vigtigste T-effektorcelletyper havde kun Th17-celler aflange mitokondrier; det vil sige, at deres indre kraftværker blev smeltet sammen til større strukturer. "Det var mærkeligt, fordi aflange mitokondrier normalt ses i hvilende celler og ikke i aktiverede celler," siger førsteforfatter Francesc Baixauli, Ph.D., en tidligere postdoktor ved Max Planck Instituttet.
Forskerne vidste, at OPA1-genet regulerer mitokondriel fusion, så de slettede det i Th17-celler og fandt ud af, at deres mitokondrier vendte tilbage til en mere fragmenteret størrelse og form. Men cellerne holdt også op med at udføre deres hovedopgave - at producere signalmolekylet interleukin-17 (IL-17).
For at bekræfte dette resultat i en organisme, slettede forskerne OPA1-genet i mus og fremmede en sygdom hos disse dyr, der modellerer human multipel sklerose, som er drevet af deres Th17-celler. Med OPA1 slettet stoppede deres celler ikke kun med at lave IL-17, men deres sygdomssymptomer aftog.
Da de spekulerede på, hvordan OPA1-sletning stoppede produktionen af IL-17, troede holdet først, at cellernes mitokondrier simpelthen ikke producerede nok energi. De fandt dog, at OPA1-deletion ikke påvirkede energiproduktionen, og at OPA1 var afgørende for produktionen af IL-17, uanset om cellernes metaboliske aktivitet var høj eller lav. Derefter fandt de ud af, at en central biokemisk proces, der fandt sted i mitokondrierne, var blevet ændret, hvilket forårsagede opbygningen af en metabolit, der vides at påvirke DNA og cellens transkriptionelle program. "Det molekyle dæmpede cellens evne til at læse dens DNA, og følgelig blev IL-17 ikke længere produceret," siger Baixauli.
For at identificere forbindelsen mellem disse responser og OPA1-deletion sammenlignede forskerne proteiner produceret af normale Th17-celler og dem uden OPA1. I celler, der mangler OPA1, fandt de en stor stigning i den aktiverede form af proteinet LKB1, som er en metabolisk sensor, der regulerer cellulært stofskifte, celledeling og mitokondriefunktion. Da de slettede både OPA1 og LKB1 fra celler, blev IL-17-produktion genoprettet, og mitokondrieprocesserne vendte tilbage til normale.
"Vi tror, at LKB1 fornemmer mitokondriel stress og ændrer mitokondriernes biokemiske reaktioner passende, hvilket påvirker produktionen af IL-17," siger Pearce. "Vi har nu en kort liste over molekyler, der vides at påvirke dette nøgleaspekt af Th17-funktionen, som kan være vendepunktet mellem dets nyttige og skadelige roller. Vores fremtidige forskning vil fortsætte med at udforske disse forhold, så vi forhåbentlig en dag kan modificere terapeutisk dem." + Udforsk yderligere
Undersøgelse afslører hovedrollen for formskiftende mitokondrier i stamcellefunktionen
 Varme artikler
Varme artikler
-
 Neanderthalere var faktisk forhistoriske PicassosDette panel i Maltravieso Cave i Spanien viser nogle håndstenciler. Forskere har dateret det til mindst 64, 000 år siden og fastslog, at det må have været lavet af en neandertaler. H. Collado/Universi
Neanderthalere var faktisk forhistoriske PicassosDette panel i Maltravieso Cave i Spanien viser nogle håndstenciler. Forskere har dateret det til mindst 64, 000 år siden og fastslog, at det må have været lavet af en neandertaler. H. Collado/Universi -
 Undersøgelse identificerer flaskehalse i tidlig havgræsvækstHavgræssens frugter Posidonia australis . Kredit:J. Statton/UWA. strandenge, vigtige planteskoler og foderpladser for mange slags havliv, går tabt verden over på grund af næringsstofforurening,
Undersøgelse identificerer flaskehalse i tidlig havgræsvækstHavgræssens frugter Posidonia australis . Kredit:J. Statton/UWA. strandenge, vigtige planteskoler og foderpladser for mange slags havliv, går tabt verden over på grund af næringsstofforurening, -
 Indsatsen sigter mod at begrænse spredningen af brandmyrer i USADette udaterede foto leveret af Blake Layton ved Mississippi State University Extension Service viser importerede brandmyrer, der bevæger sig hen over et fortov i boliger i Starkville, Miss. Brandmyre
Indsatsen sigter mod at begrænse spredningen af brandmyrer i USADette udaterede foto leveret af Blake Layton ved Mississippi State University Extension Service viser importerede brandmyrer, der bevæger sig hen over et fortov i boliger i Starkville, Miss. Brandmyre -
 Der er en genetisk grund til, at Labrador Retrievers er besat af madEn ny undersøgelse finder genetiske årsager til, at Labrador -retrievere virker mere motiverede af mad end andre racer. Neil Davis/Getty Images Hunde elsker at spise - så meget ved vi. Men har du nog
Der er en genetisk grund til, at Labrador Retrievers er besat af madEn ny undersøgelse finder genetiske årsager til, at Labrador -retrievere virker mere motiverede af mad end andre racer. Neil Davis/Getty Images Hunde elsker at spise - så meget ved vi. Men har du nog


