Hvorfor falder kogepunktet med stigning i højden?
* kogepunkt: Temperaturen, hvormed en væskes damptryk er lig med det omgivende atmosfæriske tryk, hvilket får væsken til at blive til en gas.
* atmosfærisk tryk: Luftens vægt over et bestemt sted.
hvordan det fungerer:
1. Lufttryk og højde: Når du går højere i højden, er der mindre luft over dig, hvilket fører til et fald i atmosfærisk pres.
2. damptryk: Det tryk, der udøves af dampen af en væske over dens overflade. Dette tryk øges, når væsken opvarmes.
3. ligevægt: Ved kogepunktet er væskens damptryk for det flydende lig med det atmosfæriske tryk.
4. lavere tryk, lavere kogepunkt: Da atmosfæretrykket er lavere i højere højder, har væsken brug for mindre damptryk for at nå ligevægt. Dette betyder, at væsken koger ved en lavere temperatur.
Eksempel:
Vand koger ved 100 ° C (212 ° F) ved havoverfladen, hvor det atmosfæriske tryk er ca. 1 atmosfære (ATM). Imidlertid er det atmosfæriske tryk i en højere højde som Mount Everest meget lavere, og vand koger ved ca. 68 ° C (154 ° F).
Vigtig note: Dette fald i kogepunktet er vigtigt for madlavning i højere højder, da mad tager længere tid at koge på grund af den lavere kogtemperatur i vand.
Sidste artikelEr hydrogenbromid stærk eller svag elektrolyt?
Næste artikelGiv et eksempel på et groft fast stof?
 Varme artikler
Varme artikler
-
 Metoden undersøger hurtigt atomtynde materialers evne til at producere brintEn teknik udviklet af Rice University og Los Alamos National Laboratory vil give forskere mulighed for hurtigt at undersøge atomtykke materialer for at måle brintproduktion. Rislaboratoriet bruger en
Metoden undersøger hurtigt atomtynde materialers evne til at producere brintEn teknik udviklet af Rice University og Los Alamos National Laboratory vil give forskere mulighed for hurtigt at undersøge atomtykke materialer for at måle brintproduktion. Rislaboratoriet bruger en -
 Opskalering af tannin-varmtvandsudvindingKredit:BBEPP Rehap kortlagde for nylig den rigelige forsyning af skovbrugsaffald i Europa, og hvor det mest bæredygtigt kan hentes fra. Med denne viden, Projektstudier har forsket i den bedst egne
Opskalering af tannin-varmtvandsudvindingKredit:BBEPP Rehap kortlagde for nylig den rigelige forsyning af skovbrugsaffald i Europa, og hvor det mest bæredygtigt kan hentes fra. Med denne viden, Projektstudier har forsket i den bedst egne -
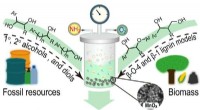 Ny strategi muliggør successiv spaltning og funktionalisering af C–C-bindinger i alkoholerSkematiske illustrationer af manganoxid til katalytisk spaltning og funktionalisering af alkoholreaktion. Kredit:He Peipei Et forskerhold ledet af prof. Dai Wen fra Dalian Institute of Chemical Phy
Ny strategi muliggør successiv spaltning og funktionalisering af C–C-bindinger i alkoholerSkematiske illustrationer af manganoxid til katalytisk spaltning og funktionalisering af alkoholreaktion. Kredit:He Peipei Et forskerhold ledet af prof. Dai Wen fra Dalian Institute of Chemical Phy -
 Hvor længe holder hukommelsen? Til formhukommelseslegeringer, jo længere jo bedreKredit:CC0 Public Domain Kendt for mange som muskeltråd eller memory metal, formhukommelseslegeringer er materialer, der kan bøjes eller deformeres, og derefter vende tilbage til deres oprindelige
Hvor længe holder hukommelsen? Til formhukommelseslegeringer, jo længere jo bedreKredit:CC0 Public Domain Kendt for mange som muskeltråd eller memory metal, formhukommelseslegeringer er materialer, der kan bøjes eller deformeres, og derefter vende tilbage til deres oprindelige
- Ny ferskvandsdatabase fortæller vandkvalitetshistorie for 12K søer globalt
- Flere minoriteter mærkede indlæringshandicap på grund af sociale uligheder, undersøgelse finder
- Tangskove er en overset komponent i oceanisk kulstoflagring, viser undersøgelser
- Er Everests berømte Hillary Step virkelig faldet sammen? Her er videnskaben
- Sådan beregnes Square Miles
- Hvorfor går ørkenplanter grødet?


