Er et meget brændbart stof også et reaktivt stof?
Brændbarhed Henviser til den lethed, hvorpå et stof antændes og forbrænder. Dette bestemmes stort set af dets:
* flammepunkt: Den laveste temperatur, hvorpå et stof giver nok damp til at antænde.
* Tændingstemperatur: Den minimale temperatur, der kræves for at starte forbrænding uden en ekstern tændingskilde.
reaktivitet Beskriver, hvor let et stof gennemgår kemisk ændring, især i forhold til andre stoffer. Dette kan involvere:
* Oxidation: Reaktion med ilt, som kan frigive varme og være eksplosiv.
* redoxreaktioner: Reaktioner, der involverer overførsel af elektroner.
* Nedbrydning: Opbrydelse af enklere stoffer.
Her er forbindelsen:
* Mange stærkt brændbare stoffer er reaktive: De reagerer let med ilt, ofte på en hurtig og eksotermisk måde, hvilket forårsager forbrænding. Dette er grunden til, at brandfarlige væsker som benzin er meget reaktive med ilt.
* Ikke alle reaktive stoffer er meget brændbare: Nogle stoffer kan reagere let uden at involvere ild. For eksempel reagerer natrium kraftigt med vand, der producerer varme og brintgas, men denne reaktion betragtes ikke som forbrænding.
Eksempler:
* meget brændbar og reaktiv: Diethylether, benzin, metan
* meget brændbar, men ikke nødvendigvis stærkt reaktiv: Træ, papir (forbrænding er en kompleks reaktion med ilt, men ikke nødvendigvis et "reaktivt" stof i kemisk forstand)
* reaktiv, men ikke meget brændbar: Natriummetal (reagerer voldsomt med vand, men brænder ikke)
Kortfattet:
Brændbarhed og reaktivitet er relaterede koncepter, men ikke synonyme. Mens mange brændbare stoffer er reaktive, er ikke alle reaktive stoffer brændbare.
Sidste artikelAngiv en test for tilstedeværelsen af brint?
Næste artikelHvad har alle faste stoffer hvad til fælles?
 Varme artikler
Varme artikler
-
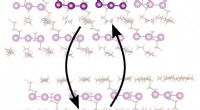 Nyt mellemprodukt opdaget til fotodissociation af triiodidanion, en klassisk lærebogsreaktionBilledet illustrerer fotodissociationen af triiodid initieret af en laserpuls og den sekundære reaktion, der fører til det nye 4-atom mellemprodukt, efterfulgt af rekombinationsreaktionen. Kredit:Bi
Nyt mellemprodukt opdaget til fotodissociation af triiodidanion, en klassisk lærebogsreaktionBilledet illustrerer fotodissociationen af triiodid initieret af en laserpuls og den sekundære reaktion, der fører til det nye 4-atom mellemprodukt, efterfulgt af rekombinationsreaktionen. Kredit:Bi -
 Brændstofaerosoler reducerer forurening af miljøetKredit:Tomsk Polytechnic University (TPU) En ressourceeffektiv teknologi til produktion af brændstofaerosoler er blevet udviklet ved Tomsk Polytechnic University. Udviklingen kan bruges til hurtig
Brændstofaerosoler reducerer forurening af miljøetKredit:Tomsk Polytechnic University (TPU) En ressourceeffektiv teknologi til produktion af brændstofaerosoler er blevet udviklet ved Tomsk Polytechnic University. Udviklingen kan bruges til hurtig -
 Se, hvordan en kovalent polymer udvikler sig ved hjælp af et scanningstunnelmikroskopUorden-til-orden overgang. Kredit:Nature (2022). DOI:10.1038/s41586-022-04409-6 Et team af forskere fra KU Leuven, University of Aveiro, OLYMAT, University of the Basque Country UPV/EHU og Ikerbasq
Se, hvordan en kovalent polymer udvikler sig ved hjælp af et scanningstunnelmikroskopUorden-til-orden overgang. Kredit:Nature (2022). DOI:10.1038/s41586-022-04409-6 Et team af forskere fra KU Leuven, University of Aveiro, OLYMAT, University of the Basque Country UPV/EHU og Ikerbasq -
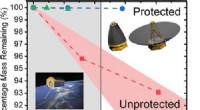 Gennembrudsmateriale kan beskytte satellitter mod ultraviolet stråling og atomært ilt i en bane ud…Kredit:ACS Atomisk ilt dannes, når O 2 molekyler går i stykker, en proces gjort lettere i rummet på grund af overflod af ultraviolet stråling. Ifølge NASA, 96 procent af lav-jordens kredsløbets
Gennembrudsmateriale kan beskytte satellitter mod ultraviolet stråling og atomært ilt i en bane ud…Kredit:ACS Atomisk ilt dannes, når O 2 molekyler går i stykker, en proces gjort lettere i rummet på grund af overflod af ultraviolet stråling. Ifølge NASA, 96 procent af lav-jordens kredsløbets
- Hvor i en eukaryot celle finder anaerob respiration sted?
- Grafen er stærkt, men det er hårdt?
- Nøglen til at udvide genetisk kode beskrevet
- Hvordan spøgelsesstrømme og redlining's arv fører til uretfærdighed i oversvømmelsesrisiko Detr…
- Centipedes i Californien
- Kaffemaskine hjælper fysikere med at lave mere effektive ionfælder


