Hvad er tre tilstande. Kemisk egenskab Et stof bestemmer dets tilstand?
1. fast: Har en bestemt form og volumen. Partiklerne er tæt pakket og vibrerer i faste positioner.
2. væske: Har et bestemt volumen, men har formen på sin beholder. Partiklerne er tæt sammen, men kan bevæge sig frit.
3. gas: Har ingen bestemt form eller volumen og fylder dens beholder. Partiklerne er langt fra hinanden og bevæger sig tilfældigt.
Den kemiske egenskab ved et stof, der bestemmer dets tilstand, er styrken af de intermolekylære kræfter mellem dens partikler.
* Stærke intermolekylære kræfter: Føre til faste stoffer, hvor partikler holdes tæt sammen.
* Moderat intermolekylære kræfter: Føre til væsker, hvor partikler kan bevæge sig rundt, men stadig oplever tiltrækning.
* svage intermolekylære kræfter: Føre til gasser, hvor partikler er langt fra hinanden og har minimal tiltrækning.
Faktorer, der påvirker intermolekylære kræfter:
* Type molekyle: Polære molekyler har stærkere kræfter end ikke -polære molekyler.
* molekylær størrelse: Større molekyler har stærkere kræfter på grund af øget overfladeareal.
* Temperatur: Forøget temperatur svækker intermolekylære kræfter og favoriserer væske- eller gastilstanden.
* tryk: Øget tryk kan tvinge partikler tættere sammen, hvilket favoriserer den faste eller flydende tilstand.
Sidste artikelHvordan bevæger Euglena Volvox Paramium og Amoeba sig?
Næste artikelHvad er nogle af de produkter, der produceres af IKA?
 Varme artikler
Varme artikler
-
 Flydende krystaller skaber letlæselige, farveskiftende sensorerPME-forskere og ingeniører har udviklet en måde at strække og spænde flydende krystaller på for at generere forskellige farver. Dette kunne anvendes i smarte belægninger, sensorer, og bærbar elektroni
Flydende krystaller skaber letlæselige, farveskiftende sensorerPME-forskere og ingeniører har udviklet en måde at strække og spænde flydende krystaller på for at generere forskellige farver. Dette kunne anvendes i smarte belægninger, sensorer, og bærbar elektroni -
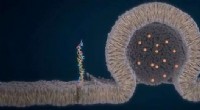 Sådan dannes en kanal mellem to organellerKreditering:Je-Kyung Ryu Kanalen, gennem hvilken to cellekomponenter udveksler materiale, ser ud til at dannes ved kanten af deres kontaktflade, og ikke i midten. Dette blev opdaget af de Leiden
Sådan dannes en kanal mellem to organellerKreditering:Je-Kyung Ryu Kanalen, gennem hvilken to cellekomponenter udveksler materiale, ser ud til at dannes ved kanten af deres kontaktflade, og ikke i midten. Dette blev opdaget af de Leiden -
 Proteiner daterer sig tilbage til sabeltandets tidKredit:University of Western Australia Planteforskere ved University of Western Australia har opdaget en helt ny familie af små proteiner kaldet PLPer (PawL Peptides), der dannes ved at piggybacke
Proteiner daterer sig tilbage til sabeltandets tidKredit:University of Western Australia Planteforskere ved University of Western Australia har opdaget en helt ny familie af små proteiner kaldet PLPer (PawL Peptides), der dannes ved at piggybacke -
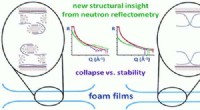 Skål! Forskere tager et stort skridt i retning af at lave det perfekte hoved af ølKredit: Kemisk kommunikation (2019). DOI:10.1039/C9CC08470C Drikkere vil snart juble hele vejen til baren takket være et team af forskere, der har taget et stort skridt fremad med at løse gåden o
Skål! Forskere tager et stort skridt i retning af at lave det perfekte hoved af ølKredit: Kemisk kommunikation (2019). DOI:10.1039/C9CC08470C Drikkere vil snart juble hele vejen til baren takket være et team af forskere, der har taget et stort skridt fremad med at løse gåden o
- Undersøgelse viser svag tillid til canadiske domstole med hensyn til energiprojekter, klimapolitisk…
- Sastrugi:Naturers smukke fartbump
- Ingeniører arbejder på lovende ny hukommelsesteknologi
- Bæredygtig turisme – eller en selfie? Økoturismes fans kan være i det for 'grammet
- Horseshoe Crab Science Project
- Transistorer og dioder fremstillet af avancerede halvledermaterialer kunne yde meget bedre end silic…


