Hvorfor er den molekylære geometri af vand bøjet?
1. Oxygen's elektronkonfiguration: Oxygen har seks elektroner i sin ydre skal, og den har brug for to mere for at afslutte sin Octet. Det opnår dette ved at danne to kovalente bindinger med to hydrogenatomer.
2. ensomme par elektroner: Oxygen har to ensomme par elektroner i sin ydre skal. Disse ensomme par afviser bindingsparene elektroner og skubber de to hydrogenatomer tættere sammen.
3. VSEPR -teori: Valence Shell Electron Pair Repulsion (VSEPR) -teorien siger, at elektronpar omkring et centralt atom vil arrangere sig selv for at minimere frastødning. De to ensomme par på ilt udøver en stærkere frastødende kraft end bindingsparene, hvilket får brintatomerne til at skubbes ned, hvilket resulterer i en bøjet form.
4. hybridisering: Oxygen's atomiske orbitaler hybridiserer til dannelse af fire SP3 -hybrid -orbitaler. To af disse orbitaler danner kovalente bindinger med brintatomerne, mens de to andre orbitaler er besat af de ensomme par. Denne hybridisering bidrager yderligere til den bøjede form.
Kortfattet: Den bøjede form af vand er et resultat af kombinationen af Oxygen's elektronkonfiguration, ensomme parafvisning og VSEPR -teori. Denne bøjede form giver vand mange unikke egenskaber, såsom dets høje polaritet og evne til at danne brintbindinger.
Sidste artikelResulterer handlingsreaktionspar i ligevægt?
Næste artikelHvad betyder MCF naturgas?
 Varme artikler
Varme artikler
-
 Økologisk strømlagringsbatteri lavet af vanillinTU Graz-forsker Stefan Spirk har fundet en måde at erstatte flydende elektrolytter i redoxflow-batterier med vanillin. Kredit:Lunghammer - TU Graz Forskere ved TU Graz har fundet en måde at omdann
Økologisk strømlagringsbatteri lavet af vanillinTU Graz-forsker Stefan Spirk har fundet en måde at erstatte flydende elektrolytter i redoxflow-batterier med vanillin. Kredit:Lunghammer - TU Graz Forskere ved TU Graz har fundet en måde at omdann -
 Enzym fra briny dyb genopstod i laboratorietRosetprøveudtageren bruges til at indsamle bakterieprøverne fra saltvandspuljen i Det Røde Hav. Kredit:André Antunes, Edge Hill University, Storbritannien. Mystiske mikrober, der trives i varme og
Enzym fra briny dyb genopstod i laboratorietRosetprøveudtageren bruges til at indsamle bakterieprøverne fra saltvandspuljen i Det Røde Hav. Kredit:André Antunes, Edge Hill University, Storbritannien. Mystiske mikrober, der trives i varme og -
 Lithium kan nu genbrugesEn dag, elbiler skal også på skroten. Det er så meget desto større grund til at finde måder at genbruge alle komponenter i deres batterier. Kredit:Shutterstock, NTB Scanpix Lithium fra norske elbi
Lithium kan nu genbrugesEn dag, elbiler skal også på skroten. Det er så meget desto større grund til at finde måder at genbruge alle komponenter i deres batterier. Kredit:Shutterstock, NTB Scanpix Lithium fra norske elbi -
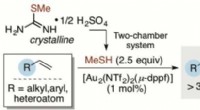 Forskere rapporterer om en enklere metode til sikker håndtering af methanthiol i kemisk synteseNy metode af professor Troels Skrydstrup ved Aarhus Universitet til hydrothiolering af π-systemer med overgangsmetalkomplekser. Kredit:Troels Skrydstrup Det kemiske grundstof svovl er en vigtig be
Forskere rapporterer om en enklere metode til sikker håndtering af methanthiol i kemisk synteseNy metode af professor Troels Skrydstrup ved Aarhus Universitet til hydrothiolering af π-systemer med overgangsmetalkomplekser. Kredit:Troels Skrydstrup Det kemiske grundstof svovl er en vigtig be
- Miljøvenlig katalysator- og materialeforskning udforsker veje til vedvarende energi
- Sådan genanvendes aircondition Vandkondensation
- Et twist i historien om vulkanudbrud og masseudryddelser
- Nanoenhed, bygge dig selv
- Hvilken del af en chloroplast er ikke involveret i lysreaktionerne?
- Selvskadende billeder på Instagram forbundet med efterfølgende selvskade hos seere


