Hvilken ud af N2 og NH3 har større værdi A, som vil b?
Forståelse af van der Waals ligning
Van der Waals ligning er:
[(P + A (N/V)^2)] * (V - NB) =NRT
Hvor:
* p: Tryk
* v: Bind
* n: Antal mol
* r: Ideel gaskonstant
* t: Temperatur
"A" og "B" værdier
* "A" (attraktion): Dette udtryk tegner sig for de attraktive kræfter mellem gasmolekyler. Større "A" -værdier indikerer stærkere intermolekylære kræfter.
* "B" (bind): Dette udtryk repræsenterer det volumen, der er optaget af selve gasmolekylerne. Større "B" -værdier indikerer større molekyler.
Sammenligning af N2 og NH3
1.. "A" værdi (attraktion): NH3 vil have en større "en" værdi end N2. Dette skyldes, at NH3 kan deltage i hydrogenbinding, en meget stærk intermolekylær kraft på grund af tilstedeværelsen af den polære N-H-binding. N2 har kun svage London -spredningskræfter.
2. "B" værdi (volumen): NH3 vil have en større "B" -værdi end N2. Dette skyldes, at NH3 -molekylet er større end N2 -molekylet.
Konklusion:
* NH3 vil have en større "en" værdi på grund af dens stærkere intermolekylære kræfter.
* NH3 vil have en større "B" -værdi, fordi dens molekyler er større.
 Varme artikler
Varme artikler
-
 Video:Kemien ved madlavningKredit:The American Chemical Society Voldsomme køkkengadgets som langsomme komfurer og trykkogere fylder meget. Mange mennesker spekulerer måske på, om det er umagen værd at eje så mange glorifice
Video:Kemien ved madlavningKredit:The American Chemical Society Voldsomme køkkengadgets som langsomme komfurer og trykkogere fylder meget. Mange mennesker spekulerer måske på, om det er umagen værd at eje så mange glorifice -
 Video:Hvad er en elektron?Kredit:The American Chemical Society Når det kommer til elektroner - en af de grundlæggende byggesten i alt stof - er der masser af ubesvarede spørgsmål. Hvor store er de? Hvad er de lavet af? Hv
Video:Hvad er en elektron?Kredit:The American Chemical Society Når det kommer til elektroner - en af de grundlæggende byggesten i alt stof - er der masser af ubesvarede spørgsmål. Hvor store er de? Hvad er de lavet af? Hv -
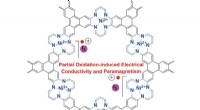 Nye 2-D metal organiske rammer med interessant elektrisk ledningsevne og magnetiske egenskaberFigur 1. Kemisk struktur af jod-dopet Ni (II) tetraaza [14] annulenbundet MOF (NiTAA-MOF). Mens NiTAA-MOF er en isolator, det oxiderede molekyle får elektrisk ledningsevne og paramagnetisme. Kredit:In
Nye 2-D metal organiske rammer med interessant elektrisk ledningsevne og magnetiske egenskaberFigur 1. Kemisk struktur af jod-dopet Ni (II) tetraaza [14] annulenbundet MOF (NiTAA-MOF). Mens NiTAA-MOF er en isolator, det oxiderede molekyle får elektrisk ledningsevne og paramagnetisme. Kredit:In -
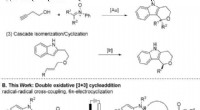 Forskere løfter sløret for en spændende ny måde at producere farmaceutiske ingredienser billiger…Tidligere udviklede syntetiske metoder og bioaktive [2, 3]‐sammensmeltede indoler. Kredit:Professor Cheol-Min Park, UNIST Et forskerhold, tilknyttet Sydkoreas Ulsan National Institute of Science a
Forskere løfter sløret for en spændende ny måde at producere farmaceutiske ingredienser billiger…Tidligere udviklede syntetiske metoder og bioaktive [2, 3]‐sammensmeltede indoler. Kredit:Professor Cheol-Min Park, UNIST Et forskerhold, tilknyttet Sydkoreas Ulsan National Institute of Science a
- Biodiversitet ophæver kulstoflagring i søgræsser, ny undersøgelse finder
- Ny meteorregn "bare et minde" om, hvad der engang var der
- Teori giver gennemsigtighed til, hvordan glas går i stykker
- Ekstraordinært stærkt, ikke-lineært optisk grafenlignende materiale kunne renovere ikke-lineær f…
- Global opvarmning i dag afspejler forhold, der fører til Jordens største udryddelsesbegivenhed, si…
- Hvad er 36,52 Celsius i Fahrenheit?


