Hvilken mængde HCL -gas skal tilsættes til 1,00 l en pufferopløsning, der indeholder eddedicacid2,0 m og acetat for at producere pH 3,88?
1. Forstå koncepterne
* bufferløsninger: Bufferopløsninger modstår ændringer i pH, når der tilsættes små mængder syre eller base. De består af en svag syre og dens konjugatbase (eller en svag base og dens konjugatsyre).
* Henderson-Hasselbalch Ligning: Denne ligning relaterer pH for en pufferopløsning til PKA for den svage syre og forholdet mellem koncentrationerne af syren og dens konjugatbase:
pH =PKA + log ([Conjugate Base]/[Syre])
* HCL (saltsyre): En stærk syre, der reagerer med acetationen (konjugatbasen) i bufferen, der skifter ligevægt og sænker pH.
2. Saml information
* pka af eddikesyre: PKA for eddikesyre er 4,74.
* ønsket pH: 3,88
* Indledende koncentrationer:
* [Eddikesyre] =2,0 m
* [Acetate] =(vi er nødt til at finde ud af dette)
* volumen af buffer: 1,00 l
3. Opret beregningen
* Find den indledende acetatkoncentration:
* Vi kender den ønskede pH og PKA. Vi kan bruge Henderson-Hasselbalch-ligningen for at finde forholdet mellem acetat og eddikesyre:
* 3,88 =4,74 + log ([acetat]/[eddikesyre])
* Løs for forholdet:[acetat]/[eddikesyre] =0,138
* Da [eddikesyre] =2,0 m, så [acetat] =0,138 * 2,0 m =0,276 m
* Beregn molen for HCL, der er nødvendig:
* Reaktionen mellem HCL og acetat er:
HCL + CH3COO--> CH3COOH + CL-
* For hver tilsat HCl -mol HCl forbruges en mol acetat, og der dannes en mol eddikesyre.
* Lad 'x' repræsentere molen af HCL -tilføjet.
* Efter tilføjelse af HCL:
* [eddikesyre] =2,0 m + x
* [acetat] =0,276 m - x
* Brug Henderson-Hasselbalch-ligningen igen med de nye koncentrationer:
3,88 =4,74 + log ((0,276 - x)/(2,0 + x))
* Løs for 'x':x =0,153 mol
4. Beregn massen af HCL
* molmasse HCL: 36,46 g/mol
* masse af HCL: 0,153 mol * 36,46 g/mol =5,58 g
Svar: Du skal tilføje cirka 5,58 gram af HCL -gas til pufferopløsningen for at opnå en pH på 3,88.
Vigtig note: Denne beregning antager ideelle forhold. I praksis er det meget vanskeligt at tilføje HCL -gas sikkert og nøjagtigt til en løsning. Det er meget sikrere at bruge en standardopløsning af HCI med en kendt koncentration for at opnå den ønskede pH.
 Varme artikler
Varme artikler
-
 Identifikation af designermedicin taget af overdosispatienterLægemidler frigivet fra testpatronen (i midten) identificeres af et massespektrometer (venstre). Kredit:Greta Ren Overdosering af stoffer tager en enorm vejafgift på folkesundheden, med potente sy
Identifikation af designermedicin taget af overdosispatienterLægemidler frigivet fra testpatronen (i midten) identificeres af et massespektrometer (venstre). Kredit:Greta Ren Overdosering af stoffer tager en enorm vejafgift på folkesundheden, med potente sy -
 Carbonbelagt nikkel muliggør en brintbrændselscelle fri for ædle metallerSTEM-billeddannelse i atomskala og EELS-spektroskopisk analyse af kerne-skal Ni@CNx elektrokatalysatorer. Kredit:Proceedings of the National Academy of Sciences (2022). DOI:10.1073/pnas.2119883119
Carbonbelagt nikkel muliggør en brintbrændselscelle fri for ædle metallerSTEM-billeddannelse i atomskala og EELS-spektroskopisk analyse af kerne-skal Ni@CNx elektrokatalysatorer. Kredit:Proceedings of the National Academy of Sciences (2022). DOI:10.1073/pnas.2119883119 -
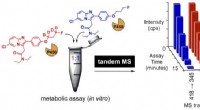 Ny screeningsmetode udviklet til at bekræfte, om deuteration forbedrer metabolisk stabilitetBilledtekst:(Venstre) Metabolsk assay i en gryde af en 1:1 blanding af deutereret og ikke-deutereret molekyle. (Højre) overvågningssignaler ved tandem MS for begge analoger (blå og røde søjler). En af
Ny screeningsmetode udviklet til at bekræfte, om deuteration forbedrer metabolisk stabilitetBilledtekst:(Venstre) Metabolsk assay i en gryde af en 1:1 blanding af deutereret og ikke-deutereret molekyle. (Højre) overvågningssignaler ved tandem MS for begge analoger (blå og røde søjler). En af -
 Hurtig test for at påvise salmonella i fødevarerTilfælde af salmonella-madforgiftning er et tilbagevendende fænomen. Råt kød er en hyppig smittekilde. Hvis rundstykket med svinetatar på billedet her var forurenet med patogener, at spise det kan før
Hurtig test for at påvise salmonella i fødevarerTilfælde af salmonella-madforgiftning er et tilbagevendende fænomen. Råt kød er en hyppig smittekilde. Hvis rundstykket med svinetatar på billedet her var forurenet med patogener, at spise det kan før
- Hvilke chacteristics of Saturn, der gør det let genkendt?
- Kan angelfish lave matematik?
- Hubble afslører tusindvis af kugleformede stjernehobe spredt blandt galakser
- Leiden fysikere billede klumpet superleder
- Brandaerosoler nedsætter det globale terrestriske økosystems produktivitet gennem ændret klima
- Forskere udvikler en billig, målrettet antibakteriel forbindelse


