Hvorfor er et molekyle, hvor ladninger er ujævnt fordelt kaldet polært molekyle?
1. Ujævn distribution af afgifter skaber poler:
* Elektronegativitet: Polære molekyler har atomer med forskellige elektronegativiteter. Elektronegativitet er et atoms evne til at tiltrække elektroner i en binding. Når to atomer med forskellige elektronegativiteter binder, tiltrækker det mere elektronegative atom de delte elektroner stærkere, hvilket skaber en delvis negativ ladning (Δ-) på det atom og en delvis positiv ladning (Δ+) på det mindre elektronegative atom.
* dipolmoment: Denne adskillelse af ladning skaber et dipolmoment, en vektormængde med en retning fra den positive pol til den negative pol.
2. Polære molekyler interagerer med andre polære molekyler:
* dipol-dipolinteraktioner: Polære molekyler kan interagere med hinanden gennem dipol-dipolkræfter. Disse kræfter opstår fra tiltrækningen mellem den positive ende af et molekyle og den negative ende af et andet molekyle.
* Hydrogenbinding: I specielle tilfælde, når et hydrogenatom er bundet til et stærkt elektronegativt atom som ilt eller nitrogen, kan en stærkere type dipol-dipolinteraktion kaldet hydrogenbinding forekomme.
3. Polære molekyler opfører sig forskelligt:
* opløselighed: Polære molekyler har en tendens til at opløses i andre polære opløsningsmidler (som vand) på grund af tiltrækningen mellem deres dipoler.
* kogepunkt: Polære molekyler har højere kogepunkter end ikke -polære molekyler på grund af de stærkere intermolekylære kræfter mellem dem.
Kortfattet: Den ujævne fordeling af ladninger i et polært molekyle skaber en adskillelse af ladninger, hvilket fører til et dipolmoment. Dette dipolmoment tillader polære molekyler at interagere med andre polære molekyler gennem dipol-dipolkræfter og hydrogenbinding, hvilket resulterer i forskellige egenskaber som højere opløselighed og kogepunkter.
 Varme artikler
Varme artikler
-
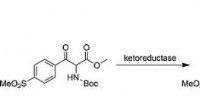 Syntese af det veterinære antibiotikum florfenicol ad en hurtig kemo-enzymatisk vejKredit: European Journal of Organic Chemistry Fluorerede strukturer udgør mere end 20 procent af moderne lægemidler, men godartede og hurtige fluoreringsskemaer er knappe. I en undersøgelse offen
Syntese af det veterinære antibiotikum florfenicol ad en hurtig kemo-enzymatisk vejKredit: European Journal of Organic Chemistry Fluorerede strukturer udgør mere end 20 procent af moderne lægemidler, men godartede og hurtige fluoreringsskemaer er knappe. I en undersøgelse offen -
 Video:Hvordan laves læder?Kredit:The American Chemical Society Den kemiske proces ved garvning gør dyrehuder til holdbare, smidigt læder. Selvom denne teknologi er tusinder af år gammel, forskere forsøger stadig at forstå
Video:Hvordan laves læder?Kredit:The American Chemical Society Den kemiske proces ved garvning gør dyrehuder til holdbare, smidigt læder. Selvom denne teknologi er tusinder af år gammel, forskere forsøger stadig at forstå -
 Undersøgelse skyller hudenKAUST-forskere har brugt komplementære teknikker til at adskille rent grænsefladeeffekter fra elektrospray-specifikke effekter. Kredit:Ivan Gromicho Fra den vindpiskede overflade af det åbne hav,
Undersøgelse skyller hudenKAUST-forskere har brugt komplementære teknikker til at adskille rent grænsefladeeffekter fra elektrospray-specifikke effekter. Kredit:Ivan Gromicho Fra den vindpiskede overflade af det åbne hav, -
 Polymer muliggør hårdere genanvendelig termoplastKredit:Unsplash/CC0 Public Domain For at syntetisere plastik, små monomermolekyler skal spændes sammen som perler i en halskæde, skabe lange polymerkæder. Imidlertid, ikke alle plastik - eller de
Polymer muliggør hårdere genanvendelig termoplastKredit:Unsplash/CC0 Public Domain For at syntetisere plastik, små monomermolekyler skal spændes sammen som perler i en halskæde, skabe lange polymerkæder. Imidlertid, ikke alle plastik - eller de
- Post-naturbrand step-pool streams
- Farveeffekter fra gennemsigtige 3D-trykte nanostrukturer
- Bæredygtige dæmninger – er de mulige? Ekspert vejer ind
- NASA annoncerer OSIRIS-REx bulkprøvemasse:121,6 gram
- NASA ser tyfonen Doksuri komme til land i Vietnam
- Nanopartikler giver en målrettet version af fototermisk terapi for kræft


