Hvad er sådan, en person kan skelne mellem syrebaser og neutrale stoffer?
1. Brug af indikatorer:
* lakmuspapir: Dette er en almindelig indikator. Rødt lakmuspapir bliver blåt i nærvær af en base, og blåt lakmuspapir bliver rød i nærvær af en syre. Det forbliver uændret i neutrale opløsninger.
* phenolphthalein: Denne indikator er farveløs i sure og neutrale opløsninger, men bliver lyserøde i grundlæggende løsninger.
* methylorange: Denne indikator er rød i sure opløsninger, gul i basale opløsninger og orange i neutrale opløsninger.
2. Måling af pH:
* pH -papir: Dette papir ændrer farve afhængigt af pH i opløsningen. Forskellige farver svarer til forskellige pH -intervaller.
* pH -meter: Denne enhed måler det elektriske potentiale for en opløsning, der er direkte relateret til dens pH.
3. Iagttagelse af kemiske egenskaber:
* syrer:
* Smag sur (smag ikke kemikalier!).
* Reager med metaller for at producere brintgas.
* Drej blåt lakmuspapir rødt.
* Reager med baser for at danne salt og vand.
* baser:
* Smag bitter (smag ikke kemikalier!).
* Føl dig glat at røre ved.
* Drej rødt lakmuspapir blåt.
* Reager med syrer for at danne salt og vand.
* neutrale stoffer:
* Har ingen tydelig smag eller fornemmelse.
* Reager ikke med hverken syrer eller baser.
4. Forståelse af den kemiske struktur:
* syrer: Indeholder hydrogenioner (H+), der kan frigøres i opløsning.
* baser: Indeholder hydroxidioner (OH-), der kan frigøres i opløsning.
* neutrale stoffer: Indeholder ikke en betydelig mængde af hverken H+ eller OH-ioner.
Vigtig note: Håndter altid syrer og baser med omhu, da de kan være ætsende og skadelige.
Ved at bruge disse metoder kan du effektivt skelne mellem syrer, baser og neutrale stoffer.
 Varme artikler
Varme artikler
-
 C9h -peptid er begrænset til at fremkalde kræftcelle -apoptoseKredit:Asociación RUVID Forskere ved Valencias Universitat Politècnica (UPV), Valencia-CSIC Biomedicine Institute (IBV) og Bioengineering, Biomateriale og nanomedicin CIBER (CIBER BBN) har udvikle
C9h -peptid er begrænset til at fremkalde kræftcelle -apoptoseKredit:Asociación RUVID Forskere ved Valencias Universitat Politècnica (UPV), Valencia-CSIC Biomedicine Institute (IBV) og Bioengineering, Biomateriale og nanomedicin CIBER (CIBER BBN) har udvikle -
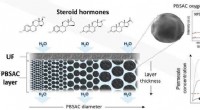 Effektiv fjernelse af steroidhormoner fra vandFiltreringssystemer med den halvgennemtrængelige membran (Ultrafiltration-UF) og et lag aktivt kul (polymerbaseret sfærisk aktivt kul-PBSAC). Kredit:IAMT/KIT Mikroforurenende stoffer forurener van
Effektiv fjernelse af steroidhormoner fra vandFiltreringssystemer med den halvgennemtrængelige membran (Ultrafiltration-UF) og et lag aktivt kul (polymerbaseret sfærisk aktivt kul-PBSAC). Kredit:IAMT/KIT Mikroforurenende stoffer forurener van -
 Solbrændstoffer fungerer godt under pres(Fra l-r) Efstathios Tingas og Wonsik Song diskuterer resultaterne af undersøgelsen med professor Hong Im. Kredit:KAUST Dylan Finol Meget brændstofeffektive nye motordesign kan reducere køretøjers
Solbrændstoffer fungerer godt under pres(Fra l-r) Efstathios Tingas og Wonsik Song diskuterer resultaterne af undersøgelsen med professor Hong Im. Kredit:KAUST Dylan Finol Meget brændstofeffektive nye motordesign kan reducere køretøjers -
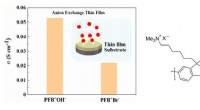 Den første hydroxidledningsevne i anionledende polymer tynde filmFigur 1:Den første måling af hydroxidledningsevne og sammenligning i anionledende polymer tynde film. (X =OH og Br). Kredit:Japan Advanced Institute of Science and Technology Efterhånden som dekar
Den første hydroxidledningsevne i anionledende polymer tynde filmFigur 1:Den første måling af hydroxidledningsevne og sammenligning i anionledende polymer tynde film. (X =OH og Br). Kredit:Japan Advanced Institute of Science and Technology Efterhånden som dekar
- Kunstig intelligens kan forudsige for tidlig død, undersøgelse finder
- Baby Yoda GIF'er er tilbage efter forvirring førte til fjernelse
- Pre-Kaikoura undersøgelse fandt huller i Kiwi tsunami bevidsthed
- Sådan fungerer Volcano Vent Tubeworms
- Sådan måles gærrespiration
- Hvordan palmeolie blev verdens mest hadede, mest brugte fedtkilde


